题目内容
14.在标准状况下a.6.72L CH4气体 b.3.01×1023个HCl气体分子 c.13.6g H2S气体 d.0.2molNH3,下列对这四种气体的关系从大到小的排列是(用上述序号表示)①四种气体所含有的分子数②③①④,
②四种气体所含有的原子数①③②④.
分析 结合n=$\frac{V}{Vm}$=$\frac{N}{N{\;}_{A}}$=$\frac{m}{M}$计算结合物质分子的构成解答.
解答 解:①6.72L CH4气体,其物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,分子数为0.3NA;原子个数为:0.3NA×5=1.5NA;
②3.01×1023个HCl气体分子,其物质的量为$\frac{3.01×10{\;}^{23}}{6.02×10{\;}^{23}}$=0.5mol,分子数为0.5NA;原子个数为:0.5NA×2=1NA;
③13.6g H2S气体,其物质的量为$\frac{13.6g}{34g/mol}$=0.4mol;分子数为:0.4NA;原子个数为:0.4NA×3=1.2NA;
④0.2mol NH3,分子数为:0.2NA;原子个数为:0.2NA×4=0.8NA;
所以:①四种气体所含有的分子数:②③①④;
故答案为:②③①④;
②四种气体所含有的原子数:①③②④;
故答案为:①③②④.
点评 本题考查物质的量的计算,为高频考点,把握以物质的量为中心的基本计算公式为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
5.NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 1 mol苯分子中含有碳碳双键数为3NA | |
| B. | 标准状况下,22.4 L己烷中共价键数目为19NA | |
| C. | 14 g乙烯和丙烯的混合气体中所含原子总数为2NA | |
| D. | 常温下,0.1 mol乙烷与乙烯混合气体中所含碳原子数为0.2NA |
2.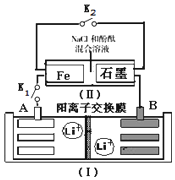 如图装置(Ⅰ)为一种可充电锂离子电池的示意图,该电池充、放电的化学方程式为:Li4Ti5O12+3Li$?_{充电}^{放电}$ Li7Ti5 O12.装置(Ⅱ)为电解池的示意图.当闭合K1,断开K2时,Fe电极附近溶液先变红.下列说法正确的是( )
如图装置(Ⅰ)为一种可充电锂离子电池的示意图,该电池充、放电的化学方程式为:Li4Ti5O12+3Li$?_{充电}^{放电}$ Li7Ti5 O12.装置(Ⅱ)为电解池的示意图.当闭合K1,断开K2时,Fe电极附近溶液先变红.下列说法正确的是( )
 如图装置(Ⅰ)为一种可充电锂离子电池的示意图,该电池充、放电的化学方程式为:Li4Ti5O12+3Li$?_{充电}^{放电}$ Li7Ti5 O12.装置(Ⅱ)为电解池的示意图.当闭合K1,断开K2时,Fe电极附近溶液先变红.下列说法正确的是( )
如图装置(Ⅰ)为一种可充电锂离子电池的示意图,该电池充、放电的化学方程式为:Li4Ti5O12+3Li$?_{充电}^{放电}$ Li7Ti5 O12.装置(Ⅱ)为电解池的示意图.当闭合K1,断开K2时,Fe电极附近溶液先变红.下列说法正确的是( )| A. | 闭合K1,断开K2时,若将Fe电极和石墨电极互换,装置(Ⅱ)中发生的总反应为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑ | |
| B. | 闭合K1,断开K2时,当0.1 mol Li+从A极区迁移到B极区,理论上Fe电极上产生的气体体积为1.12 L(标准状况下) | |
| C. | 取下锂离子电池充电,电极A为阳极,发生还氧化反应,电极上发生的电极反应式为:Li7Ti5O12-3e-═Li4Ti5O12+3 Li+ | |
| D. | 若开始时,断开K1,闭合K2,一段时间后,石墨电极附近显红色,则该电极反应为:2H++2e-═H2↑ |
9.与50mL 0.1mol•L-1 Na2CO3 溶液中 Na+ 的物质的量浓度相同的溶液是( )
| A. | 50 mL 0.2 mol•L-1 的 NaCl 溶液 | |
| B. | 100 mL 0.1 mol•L-1 的 NaCl 溶液 | |
| C. | 25 mL 0.2 mol•L-1 的 Na2SO4 溶液 | |
| D. | 10 mL 0.5mol•L-1 的 Na2CO3 溶液 |
19.7.用NA表示阿伏德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4LH2O含有的分子数为 NA | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA | |
| C. | 通常状况下,NA 个CO2分子占有的体积为22.4L | |
| D. | 物质的量为0.5 mol的MgCl2中,含有Mg2+个数为 NA |
6.下列各组物质中,第一种是酸,第二种是混合物,第三种是碱的是( )
| A. | 空气、硫酸铜、H2SO4 | B. | HCl、Fe(OH)3胶体、纯碱 | ||
| C. | 二氧化碳、胆矾、氢氧化钾 | D. | HNO3、食盐水、烧碱 |
3.2mol氢气分子和2mol氦气分子一定具有相同的( )
| A. | 原子数 | B. | 物质的量 | C. | 中子数 | D. | 体积 |
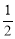 N2H4(g)+
N2H4(g)+