题目内容
7.下列有关物质结构的说法正确的是( )| A. | 共价化合物中各原子最外层都一定满足8电子结构 | |
| B. | BaO2晶体中阳离子与阴离子数目之比为1:2 | |
| C. | H2O是一种非常稳定的化合物,这是由氢键所致 | |
| D. | 在反应2Na2O2+2H2O═4NaOH+O2↑中,既有离子键、极性键和非极性键的断裂,又有离子键、极性键和非极性键的形成 |
分析 A、共价化合物中不一定各原子都满足最外层8电子稳定结构;
B、BaO2晶体中阳离子是钡离子与阴离子是过氧根离子数目之比为1:1;
C、氢键影响物质的物理性质,如溶沸点、密度等,化学键可以影响物质的物理性质,还可以影响物质的化学性质,如键能越大物质越稳定;
D、在反应2Na2O2+2H2O═4NaOH+O2↑,既有钠离子与过氧根离子之间的离子键、氢氧之间的极性键和过氧根离子中氧氧之间的非极性键的断裂,又有钠离子与氢氧根离子之间的离子键、氢氧根离子中氧氢极性键共价键和氧气分子中氧氧非极性键的形成.
解答 解:A、共价化合物中不一定各原子都满足最外层8电子稳定结构,如氢化物,故A错误;
B、BaO2晶体中阳离子是钡离子与阴离子是过氧根离子数目之比为1:1,故C错误;
C、由于氢氧键的键能较大,所以水是一种非常稳定的化合物,故C错误;
D、在反应2Na2O2+2H2O═4NaOH+O2↑,既有钠离子与过氧根离子之间的离子键、氢氧之间的极性键和过氧根离子中氧氧之间的非极性键的断裂,又有钠离子与氢氧根离子之间的离子键、氢氧根离子中氧氢极性键共价键和氧气分子中氧氧非极性键的形成,故D正确;
故选D.
点评 本题主要考查了氢键、离子晶体中微粒的数目等,难度不大,根据课本知识即可完成即可.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
17.某溶液中可能含有下列5种离子中的某几种:Na+、NH4+、Mg2+、Al3+、Clˉ.为确认该溶液组成进行如下实验:
①取20.0mL该溶液,加入25.0mL 4.00mol•L-1NaOH溶液,有白色沉淀、无剌激气味气体.过滤、洗涤、干燥,得沉淀1.16g.再将滤液稀释至100mL,测得滤液中c(OHˉ)为0.20mol•L-1;
②另取20.0mL该溶液,加入足量的AgNO3溶液,生成白色沉淀11.48g.
由此可得出关于原溶液组成的正确结论是( )
①取20.0mL该溶液,加入25.0mL 4.00mol•L-1NaOH溶液,有白色沉淀、无剌激气味气体.过滤、洗涤、干燥,得沉淀1.16g.再将滤液稀释至100mL,测得滤液中c(OHˉ)为0.20mol•L-1;
②另取20.0mL该溶液,加入足量的AgNO3溶液,生成白色沉淀11.48g.
由此可得出关于原溶液组成的正确结论是( )
| A. | 一定含有Mg2+、Al3+、Clˉ,可能含有Na+,不含NH4+ | |
| B. | 一定含有Mg2+、Clˉ,不含NH4+,可能含有Na+、Al3+ | |
| C. | c (Clˉ) 为 4.00 mol•L-1,c(Al3+)为5.00 mol•L-1 | |
| D. | c (Mg2+) 为 1.00 mol•L-1,c(Na+)为 0.5mol•L-1 |
18.用NA表示阿伏加德罗常数的值.下列说法不正确的是( )
| A. | H2O2分解产生1molO2,转移的电子数为4NA | |
| B. | 1.00mol NaCl中,所有Na+的最外层电子总数约为8 NA | |
| C. | 常温常压下,4.4gCO2与N2O混合气体中含有的原子总数为0.3NA | |
| D. | 标准状况下,2.24LCH4所含电子数为NA |
15.不能使橙色溴水层变为无色的是( )
| A. | NaOH溶液 | B. | 用CCl4多次萃取 | C. | 锌粉 | D. | KI 溶液 |
2.下列说法不符合图中漫画情景的是( )
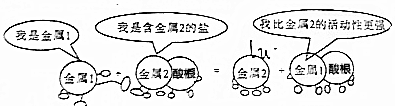

| A. | 此反应不可能是复分解反应 | |
| B. | 若金属1是锌,金属2可能是银 | |
| C. | 还原性:金属1>金属2 | |
| D. | 若金属2为铜,则反应过程中生成2mol金属2,转移的电子数为2NA |
2.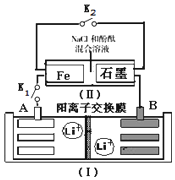 如图装置(Ⅰ)为一种可充电锂离子电池的示意图,该电池充、放电的化学方程式为:Li4Ti5O12+3Li$?_{充电}^{放电}$ Li7Ti5 O12.装置(Ⅱ)为电解池的示意图.当闭合K1,断开K2时,Fe电极附近溶液先变红.下列说法正确的是( )
如图装置(Ⅰ)为一种可充电锂离子电池的示意图,该电池充、放电的化学方程式为:Li4Ti5O12+3Li$?_{充电}^{放电}$ Li7Ti5 O12.装置(Ⅱ)为电解池的示意图.当闭合K1,断开K2时,Fe电极附近溶液先变红.下列说法正确的是( )
 如图装置(Ⅰ)为一种可充电锂离子电池的示意图,该电池充、放电的化学方程式为:Li4Ti5O12+3Li$?_{充电}^{放电}$ Li7Ti5 O12.装置(Ⅱ)为电解池的示意图.当闭合K1,断开K2时,Fe电极附近溶液先变红.下列说法正确的是( )
如图装置(Ⅰ)为一种可充电锂离子电池的示意图,该电池充、放电的化学方程式为:Li4Ti5O12+3Li$?_{充电}^{放电}$ Li7Ti5 O12.装置(Ⅱ)为电解池的示意图.当闭合K1,断开K2时,Fe电极附近溶液先变红.下列说法正确的是( )| A. | 闭合K1,断开K2时,若将Fe电极和石墨电极互换,装置(Ⅱ)中发生的总反应为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑ | |
| B. | 闭合K1,断开K2时,当0.1 mol Li+从A极区迁移到B极区,理论上Fe电极上产生的气体体积为1.12 L(标准状况下) | |
| C. | 取下锂离子电池充电,电极A为阳极,发生还氧化反应,电极上发生的电极反应式为:Li7Ti5O12-3e-═Li4Ti5O12+3 Li+ | |
| D. | 若开始时,断开K1,闭合K2,一段时间后,石墨电极附近显红色,则该电极反应为:2H++2e-═H2↑ |
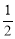 N2H4(g)+
N2H4(g)+