题目内容
10.将金属钠分别投入下列物质的水溶液中,生成白色沉淀的是( )| A. | HCl | B. | BaCl2 | C. | CuCl2 | D. | MgCl2 |
分析 金属钠分别投入盐的水溶液中,钠和水发生:2Na+2H2O=2NaOH+H2↑,根据NaOH的性质判断.
解答 解:A.钠和水发生:2Na+2H2O=2NaOH+H2↑,NaOH和HCl反应生成氯化钠和水,无沉淀生成,故A不选;
B.钠和水发生:2Na+2H2O=2NaOH+H2↑,NaOH和BaCl2不反应,故B不选;
C.钠和水发生:2Na+2H2O=2NaOH+H2↑,NaOH和CuCl2反应生成氢氧化铜蓝色沉淀,故C不选;
D.发生:2Na+2HCl=2NaCl+H2↑,MgCl2溶液中有氢氧化镁沉淀生成,故D选.
故选D.
点评 本题考查钠的性质,题目难度不大,注意把握钠的水的反应,学习中注意相关基础知识的积累.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.不能使橙色溴水层变为无色的是( )
| A. | NaOH溶液 | B. | 用CCl4多次萃取 | C. | 锌粉 | D. | KI 溶液 |
5.NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 1 mol苯分子中含有碳碳双键数为3NA | |
| B. | 标准状况下,22.4 L己烷中共价键数目为19NA | |
| C. | 14 g乙烯和丙烯的混合气体中所含原子总数为2NA | |
| D. | 常温下,0.1 mol乙烷与乙烯混合气体中所含碳原子数为0.2NA |
15.已知:常温下浓度为0.1mol•L-1的下列溶液的pH如下表:下列有关说法正确的是( )
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A. | 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF | |
| B. | 若将CO2通入0.1 mol•L-1 Na2CO3溶液中至溶液呈中性,则溶液中:2c(CO32-)+c(HCO3-)=0.1 mol•L-1 | |
| C. | 向上述NaClO溶液中通HF气体至恰好完全反应时:c(Na+)>c(F-)>c(H+)>c(HClO)>c(OH-) | |
| D. | 根据上表水解方程式ClO-+H2O?HClO+OH-的平衡常数K≈10-7.6 |
2.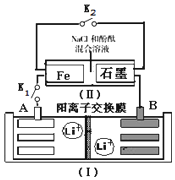 如图装置(Ⅰ)为一种可充电锂离子电池的示意图,该电池充、放电的化学方程式为:Li4Ti5O12+3Li$?_{充电}^{放电}$ Li7Ti5 O12.装置(Ⅱ)为电解池的示意图.当闭合K1,断开K2时,Fe电极附近溶液先变红.下列说法正确的是( )
如图装置(Ⅰ)为一种可充电锂离子电池的示意图,该电池充、放电的化学方程式为:Li4Ti5O12+3Li$?_{充电}^{放电}$ Li7Ti5 O12.装置(Ⅱ)为电解池的示意图.当闭合K1,断开K2时,Fe电极附近溶液先变红.下列说法正确的是( )
 如图装置(Ⅰ)为一种可充电锂离子电池的示意图,该电池充、放电的化学方程式为:Li4Ti5O12+3Li$?_{充电}^{放电}$ Li7Ti5 O12.装置(Ⅱ)为电解池的示意图.当闭合K1,断开K2时,Fe电极附近溶液先变红.下列说法正确的是( )
如图装置(Ⅰ)为一种可充电锂离子电池的示意图,该电池充、放电的化学方程式为:Li4Ti5O12+3Li$?_{充电}^{放电}$ Li7Ti5 O12.装置(Ⅱ)为电解池的示意图.当闭合K1,断开K2时,Fe电极附近溶液先变红.下列说法正确的是( )| A. | 闭合K1,断开K2时,若将Fe电极和石墨电极互换,装置(Ⅱ)中发生的总反应为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑ | |
| B. | 闭合K1,断开K2时,当0.1 mol Li+从A极区迁移到B极区,理论上Fe电极上产生的气体体积为1.12 L(标准状况下) | |
| C. | 取下锂离子电池充电,电极A为阳极,发生还氧化反应,电极上发生的电极反应式为:Li7Ti5O12-3e-═Li4Ti5O12+3 Li+ | |
| D. | 若开始时,断开K1,闭合K2,一段时间后,石墨电极附近显红色,则该电极反应为:2H++2e-═H2↑ |
19.7.用NA表示阿伏德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4LH2O含有的分子数为 NA | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA | |
| C. | 通常状况下,NA 个CO2分子占有的体积为22.4L | |
| D. | 物质的量为0.5 mol的MgCl2中,含有Mg2+个数为 NA |
19.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 1.0mol•L-1KNO3溶液:H+、Fe2+、SCN-、SO42- | |
| B. | 中性溶液:Fe3+、K+、Cl-、SO42- | |
| C. | c(H+)/c(OH-)=10-10的溶液:Ba2+、NO3-、Cl- | |
| D. | c(ClO-)=1.0mol•L-1的溶液:Na+、SO32-、S2-、SO42- |