题目内容
8.已知:常温下浓度为0.1mol•L-1的下列溶液的pH如表:| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A. | 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF | |
| B. | 若将0.2 mol•L-1Na2CO3和0.1 mol•L-1NaHCO3溶液等体积混合,则溶液中:3c(OHˉ)=3c(H+)+2c(HCO3ˉ)+5c(H2CO3)+c(CO32ˉ) | |
| C. | 根据上表,反应ClOˉ+H2O?HClO+OHˉ的水解常数Kh≈10ˉ7.6 | |
| D. | 向上述NaClO 溶液中通HF气体至恰好完全反应时:c(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OH-) |
分析 相同浓度的钠盐溶液碱性越强,说明酸根离子水解程度越大,则相应酸的酸性越弱,酸的电离平衡常数越小,根据钠盐溶液的pH知,酸根离子水解程度CO32->ClO->F-,酸的电离平衡常数从小到大顺序是:HCO3-<HClO<HF,以此解答该题.
解答 解:相同浓度的钠盐溶液碱性越强,说明酸根离子水解程度越大,则相应酸的酸性越弱,酸的电离平衡常数越小,根据钠盐溶液的pH知,酸根离子水解程度CO32->ClO->F-,酸的电离平衡常数从小到大顺序是:HCO3-<HClO<HF,
A.酸的电离平衡常数从小到大顺序是:HCO3-<HClO<HF,在相同温度下,同浓度的三种酸溶液的导电能力顺序:HCO3-<HClO<HF,但酸性H2CO3>HClO,故A错误;
B.溶液存在电荷守恒c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) ①
溶液中还存在物料守恒:3c(Na+)=5c(HCO3-)+5c(CO32- )+5c(H2CO3) ②
将①×3-②可得:3c(OHˉ)-c(CO32- )=3c(H+)+2c(HCO3ˉ)+5c(H2CO3),故B错误;
C.式ClO-+H2O?HClO+OH-的平衡常数为K=$\frac{c(HClO)×c(O{H}^{-})}{c(Cl{O}^{-})}$=$\frac{1{0}^{-4.3}×1{0}^{-4.3}}{0.1}$=10-7.6,故C正确;
D.反应后生成HClO,由于电离程度较弱,则c(HClO)>c(H+),故D错误.
故选C.
点评 本题考查较为综合,涉及弱电解质的电离和盐类的水解,为高频考点,注意从电荷守恒的角度解答,难度不大.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案
相关题目
18.下列叙述正确的是( )
| A. | BaC03是难溶于水的强电解质,在医学上用作钡餐 | |
| B. | 常用电解熔融氯化铝和冰晶石的混合物方法冶炼铝 | |
| C. | 明矾净水,硫酸铜溶液作农药,都与金属离子的水解有关 | |
| D. | 锅炉水垢中含有的CaSO4,可先用饱和碳酸钠溶液处理,而后用盐酸除去 |
3.在一定温度下,向饱和烧碱溶液中放入一定量的Na2O2,完合反应恢复到原温度,下列说法正确的是( )
| A. | 溶液中[Na+]增大,有O2放出 | B. | 溶液PH值不变,有H2放出 | ||
| C. | 溶液中Na+数目减少,有O2放出 | D. | 溶液中PH值不变,有O2放出 |
17.下列叙述不正确的是( )
| A. | 苯、乙醇和乙酸都能发生取代反应 | |
| B. | 等物质的量的乙醇和乙酸完全燃烧时所需氧气的质量相等 | |
| C. | 乙醇、乙酸和乙酸乙酯能用饱和NaHCO3溶液鉴别 | |
| D. | 乙烷和丙烯的物质的量各1mol,完成燃烧生成3molH2O |
18.“向海洋进军”,已成为世界许多国家发展的战略口号,海水中通常含有较多的Ca2+、Mg2+、$SO_4^{2-}$等杂质离子,以海盐为原料的氯碱厂电解饱和食盐水制取NaOH的工艺流程如下:
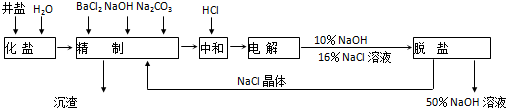
依据如图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极的电极反应式为2Cl--2e-=Cl2↑;
(2)电解过程的总反应的化学方程式2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑.
(3)电解槽阳极产物可用于制漂白粉、生产盐酸、自来水消毒、制高纯硅、合成塑料等(任写2种)(至少写出两种用途).
(4)工业食盐含Ca2+、Mg2+等杂质,精制过程中除去这2种离子所发生反应的离子方程式为:Ca2++CO32-=CaCO3↓、Mg2++2OH-=Mg(OH)2↓.
(5)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是a、c
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(6)为了有效除去Ca2+、Mg2+、SO42-加入试剂的合理顺序为b、c
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(7)已知NaOH、NaCl在水中的溶解度数据如下表:
根据上述数据,脱盐工序中利用通过蒸发结晶、趁热过滤(填操作名称)除去NaCl.

依据如图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极的电极反应式为2Cl--2e-=Cl2↑;
(2)电解过程的总反应的化学方程式2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑.
(3)电解槽阳极产物可用于制漂白粉、生产盐酸、自来水消毒、制高纯硅、合成塑料等(任写2种)(至少写出两种用途).
(4)工业食盐含Ca2+、Mg2+等杂质,精制过程中除去这2种离子所发生反应的离子方程式为:Ca2++CO32-=CaCO3↓、Mg2++2OH-=Mg(OH)2↓.
(5)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是a、c
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(6)为了有效除去Ca2+、Mg2+、SO42-加入试剂的合理顺序为b、c
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(7)已知NaOH、NaCl在水中的溶解度数据如下表:
| 温度/℃ | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| NaOH/g | 109 | 118 | 129 | 146 | 177 | 300 | 313 | 318 | 337 |
| NaCl/g | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
 .
.