题目内容
4.(1)把铁、铝混合物1.66g溶于200ml 5mol/L盐酸中,反应后盐酸的浓度变为4.5mol/L(溶液体积变化忽略不计).求:①反应中消耗HCl的物质的量
②该混合物中铝、铁的物质的量
(2)将10g铁片放入100ml硫酸铜溶液中,溶液中的Cu2+全部被还原时,金属固体变为10.8g.求:
①剩余的铁的质量
②原硫酸铜溶液的物质的量浓度.
分析 (1)①利用n=cV,根据反应前HCl的物质的量减去反应后溶液中HCl的物质的量来计算;
②根据金属的质量之和为1.66g及反应中消耗的HCl来列式计算即可;
(2)根据发生的反应:Fe+CuSO4═FeSO4+Cu,利用差量法来计算溶液中硫酸铜的物质的量,进而计算其物质的量浓度.
解答 解:(1)①反应中消耗HCl的物质的量为:0.2 L×5mol•L-1-0.2 L×4.5mol•L-1=0.1mol,
答:反应中消耗HCl的物质的量为0.1mol;
②设Al、Fe的物质的量分别为x、y
由2Al+6HCl═2AlCl3+3H2↑、Fe+2HCl═FeCl2+H2↑
则Al~3HCl Fe~2HCl
x 3x y 2y
$\left\{\begin{array}{l}{27x+56y=1.66g}\\{3x+2y=0.1mol}\end{array}\right.$,
解得:x=0.02mol、y=0.02mol,
答:该混合物中铝、铁的物质的量分别为0.02mol、0.02mol;
(2)设原溶液中硫酸铜的物质的量为xmol,则:
Fe+CuSO4═FeSO4+Cu△m
1mol 64g-56g=8g
xmol 10.8g-10g=0.8g
1mol:xmol=8g:0.8g
解得x=0.1,n(Fe)=n(CuSO4)=0.1mol,即参加反应的铁的物质的量为0.1mol,所以剩余的铁的质量10g-5.6g=4.4g,
则原溶液中CuSO4的物质的量浓度=$\frac{0.1mol}{0.1L}$=1mol/L,
答:①剩余的铁的质量为4.4g;
②原硫酸铜溶液的物质的量浓度为1mol/L.
点评 本题考查化学反应方程式的计算,注意利用差量法来计算,简化计算过程,难度不大.

 阅读快车系列答案
阅读快车系列答案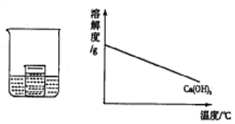 如图所示,在小烧杯中盛有饱和石灰水,大烧杯中盛有试剂X.将试剂Y加入到大烧杯X中,观察到小烧杯中的现象正确的是( )
如图所示,在小烧杯中盛有饱和石灰水,大烧杯中盛有试剂X.将试剂Y加入到大烧杯X中,观察到小烧杯中的现象正确的是( )| 序号 | 试剂X | 试剂Y | 小烧杯中的现象 |
| A | 水 | 硝酸铵 | 产生白色沉淀 |
| B | 水 | 浓硫酸 | 无明显变化 |
| C | 盐酸 | 镁条 | 产生白色沉淀 |
| D | 硫酸 | 氢氧化钠 | 无明显变化 |
| A. | A | B. | B | C. | C | D. | D |
| A. |  | B. |  | C. |  | D. |  |
(1)从淡化海水中提取溴的流程如下:
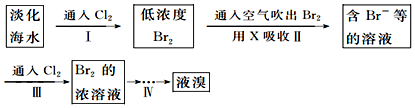
下列有关说法不正确的是C
A.X试剂可用饱和Na2SO3溶液
B.步骤Ⅰ的离子方程式:2Br-+Cl2=2Cl-+Br2
C.工业上每获得1molBr2,需要消耗Cl244.8L
D.步骤Ⅳ包含萃取、分液和蒸馏
(2)ClO2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛.某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究.下面说法不合理的是D
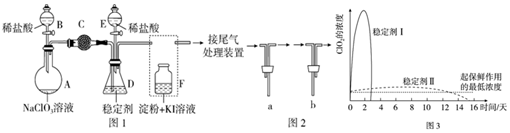
A、打开B的活塞,A中发生反应:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O,为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜慢.
B、关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是吸收Cl2.
C、已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2.在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2生成
D、已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示.若将其用于水果保鲜,你认为效果较好的稳定剂是稳定剂I,原因是可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度.(3)常温下,已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | HClO | H2CO3 |
| 电离常数 | K=4.7×10-8 | K1=4.3×10-7, |
| K2=5.6×10-11 |
(4)服用含碘化钾的碘药片可抗核辐射.将碘药片剥去糖衣皮研碎后置于试管中制得无色水溶液,并加入几滴淀粉试液,然后向试管中逐滴加入氯水,观察到溶液由无色变为蓝色,若继续滴加氯水,蓝色溶液又褪为无色.完成并配平溶液由蓝色变为无色的化学反应方程式(如果化学计量数是1,不用填写):5Cl2+I2+6H2O=2HIO3+10HCl.
| A. | Zn片是正极,Cu片是负极 | B. | 电流方向是从Zn经外电路流向Cu | ||
| C. | 电解液的PH保持不变 | D. | Cu片上有气泡产生 |
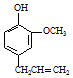 丁子香酚可用于配制康乃馨型香精及制作杀虫剂和防腐剂,结构简式如图.
丁子香酚可用于配制康乃馨型香精及制作杀虫剂和防腐剂,结构简式如图. .
.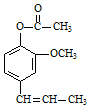 →A$→_{一定条件}^{CH_{3}CH_{2}Cl}$B(C12H16O2)→C(
→A$→_{一定条件}^{CH_{3}CH_{2}Cl}$B(C12H16O2)→C(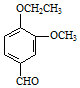 )
)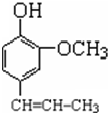 +CH3CH2Cl$\stackrel{一定条件}{→}$
+CH3CH2Cl$\stackrel{一定条件}{→}$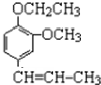 +HCl,反应类型为取代反应.C中滴加少量溴水振荡,主要现象为褪色.
+HCl,反应类型为取代反应.C中滴加少量溴水振荡,主要现象为褪色.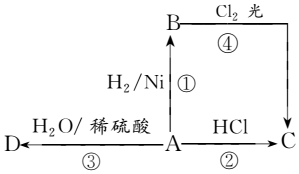 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.根据图回答下列问题:
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.根据图回答下列问题: