题目内容
1.Fe(OH)3胶体可用作净水剂,取少量Fe(OH)3胶体于试管中,向试管中逐渐滴加稀盐酸至过量,产生的现象为先聚沉为红褐色沉淀,后沉淀溶解.分析 向Fe(OH)3胶体中滴入稀盐酸,先发生胶体的聚沉,然后二者之间会发生复分解反应,氢氧化铁与盐酸发生酸碱中和反应生成氯化铁和水.
解答 解:氢氧化铁胶体中加入盐酸,先发生聚沉生成红褐色氢氧化铁沉淀,然后氢氧化铁与盐酸反应生成氯化铁和水,所以看到现象:先观察到液体中产生红褐色沉淀,后沉淀逐渐溶解,离子方程式:Fe(OH)3+3H+═Fe3++3H2O,
故意答案为:先聚沉为红褐色沉淀,后沉淀溶解.
点评 本题考查学生Fe(OH)3胶体的性质,注意知识的迁移和应用是解题关键,题目难度不大.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目
11.甲溶液的pH为4,乙溶液的pH为2,甲溶液与乙溶液的c(H+)之比为( )
| A. | 100 | B. | $\frac{1}{100}$ | C. | 2 | D. | $\frac{1}{2}$ |
9.运用化学反应原理研究卤族元素单质的有关性质具有重要意义.
(1)从淡化海水中提取溴的流程如下:
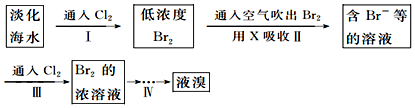
下列有关说法不正确的是C
A.X试剂可用饱和Na2SO3溶液
B.步骤Ⅰ的离子方程式:2Br-+Cl2=2Cl-+Br2
C.工业上每获得1molBr2,需要消耗Cl244.8L
D.步骤Ⅳ包含萃取、分液和蒸馏
(2)ClO2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛.某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究.下面说法不合理的是D
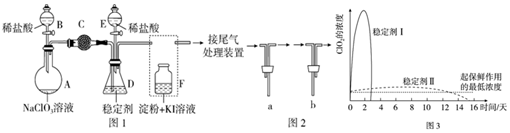
A、打开B的活塞,A中发生反应:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O,为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜慢.
B、关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是吸收Cl2.
C、已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2.在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2生成
D、已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示.若将其用于水果保鲜,你认为效果较好的稳定剂是稳定剂I,原因是可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度.(3)常温下,已知25℃时有关弱酸的电离平衡常数:
写出84消毒液(主要成分为NaClO)露置在空气中发生反应的有关化学方程式NaClO+CO2+H2O═HClO+NaHCO3;2HClO $\frac{\underline{\;关照\;}}{\;}$2HCl+O2↑.若将84消毒液与洁厕剂(含有浓盐酸)混合使用可能会导致中毒,请用离子方程式解释有关原因ClO-+Cl-+2H+═Cl2↑+H2O.
(4)服用含碘化钾的碘药片可抗核辐射.将碘药片剥去糖衣皮研碎后置于试管中制得无色水溶液,并加入几滴淀粉试液,然后向试管中逐滴加入氯水,观察到溶液由无色变为蓝色,若继续滴加氯水,蓝色溶液又褪为无色.完成并配平溶液由蓝色变为无色的化学反应方程式(如果化学计量数是1,不用填写):5Cl2+I2+6H2O=2HIO3+10HCl.
(1)从淡化海水中提取溴的流程如下:

下列有关说法不正确的是C
A.X试剂可用饱和Na2SO3溶液
B.步骤Ⅰ的离子方程式:2Br-+Cl2=2Cl-+Br2
C.工业上每获得1molBr2,需要消耗Cl244.8L
D.步骤Ⅳ包含萃取、分液和蒸馏
(2)ClO2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛.某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究.下面说法不合理的是D

A、打开B的活塞,A中发生反应:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O,为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜慢.
B、关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是吸收Cl2.
C、已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2.在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2生成
D、已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示.若将其用于水果保鲜,你认为效果较好的稳定剂是稳定剂I,原因是可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度.(3)常温下,已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | HClO | H2CO3 |
| 电离常数 | K=4.7×10-8 | K1=4.3×10-7, |
| K2=5.6×10-11 |
(4)服用含碘化钾的碘药片可抗核辐射.将碘药片剥去糖衣皮研碎后置于试管中制得无色水溶液,并加入几滴淀粉试液,然后向试管中逐滴加入氯水,观察到溶液由无色变为蓝色,若继续滴加氯水,蓝色溶液又褪为无色.完成并配平溶液由蓝色变为无色的化学反应方程式(如果化学计量数是1,不用填写):5Cl2+I2+6H2O=2HIO3+10HCl.
6. I.用NH3催化还原NxOy可以消除氮氧化物的污染.
I.用NH3催化还原NxOy可以消除氮氧化物的污染.
已知:反应①:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
反应②:2NO(g)+O2(g)?2NO2(g)△H2 (且|△H1|=2|△H2|)
反应③:4NH3(g)+6NO2(g)?5N2(g)+3O2(g)+6H2O(l)△H3
反应①和反应②在不同温度时的平衡常数及其大小关系如表
(1)推测反应③是吸热反应(填“吸热”或“放热”)
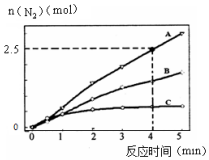
(2)相同条件下,反应①在2L密闭容器内,选用不同催化剂,反应产生N2的量随时间变化如图所示.
①计算0~4分钟在A催化剂作用下,反应速率v(NO)=0.375mol•L-1•min-1.
②下列说法正确的是CD.
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当温度不变时,说明反应已经达到平衡.
 I.用NH3催化还原NxOy可以消除氮氧化物的污染.
I.用NH3催化还原NxOy可以消除氮氧化物的污染.已知:反应①:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
反应②:2NO(g)+O2(g)?2NO2(g)△H2 (且|△H1|=2|△H2|)
反应③:4NH3(g)+6NO2(g)?5N2(g)+3O2(g)+6H2O(l)△H3
反应①和反应②在不同温度时的平衡常数及其大小关系如表
| 温度/K | 反应① | 反应② | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
(2)相同条件下,反应①在2L密闭容器内,选用不同催化剂,反应产生N2的量随时间变化如图所示.
①计算0~4分钟在A催化剂作用下,反应速率v(NO)=0.375mol•L-1•min-1.
②下列说法正确的是CD.
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当温度不变时,说明反应已经达到平衡.
10.化学与材料、生活和环境密切相关.下列说法正确的是( )
| A. | 糖、油脂、蛋白质都可以生水解反应 | |
| B. | 天然纤维、聚酚纤维、光导纤维都属于有机高分子材料 | |
| C. | 大力实施矿物燃料脱硫、脱硝技术以减少硫、氮氧化物排放 | |
| D. | 镀锌铁或镀锡铁镀层破损后仍将通过牺牲阳极的阴极保护法防止腐蚀 |
5.天然铊有两种稳定同位素,${\;}_{81}^{203}$Tl和${\;}_{81}^{205}$Tl.下列有关铊的同位素说法中,不正确的是( )
| A. | ${\;}_{81}^{203}$Tl 和 ${\;}_{81}^{205}$Tl 质子数相同 | |
| B. | ${\;}_{81}^{203}$Tl 和 ${\;}_{81}^{205}$Tl互为同素异形体 | |
| C. | ${\;}_{81}^{203}$Tl 和 ${\;}_{81}^{205}$Tl中子数之差为2 | |
| D. | ${\;}_{81}^{205}$Tl 原子核内中子数与核外电子数之差为43 |
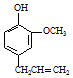 丁子香酚可用于配制康乃馨型香精及制作杀虫剂和防腐剂,结构简式如图.
丁子香酚可用于配制康乃馨型香精及制作杀虫剂和防腐剂,结构简式如图.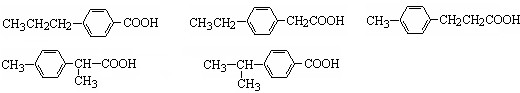 .
.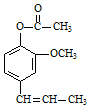 →A$→_{一定条件}^{CH_{3}CH_{2}Cl}$B(C12H16O2)→C(
→A$→_{一定条件}^{CH_{3}CH_{2}Cl}$B(C12H16O2)→C(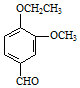 )
)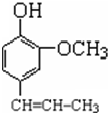 +CH3CH2Cl$\stackrel{一定条件}{→}$
+CH3CH2Cl$\stackrel{一定条件}{→}$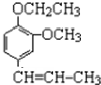 +HCl,反应类型为取代反应.C中滴加少量溴水振荡,主要现象为褪色.
+HCl,反应类型为取代反应.C中滴加少量溴水振荡,主要现象为褪色.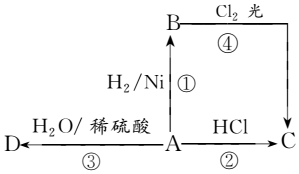 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.根据图回答下列问题:
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.根据图回答下列问题: