题目内容
17.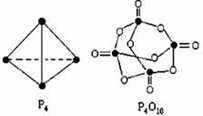 白磷与氧可发生如下反应:P4+5O2=P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P akJ•mol-1、P-O bkJ•mol-1、P=O ckJ•mol-1、O=O dkJ•mol-1根据图示的分子结构和有关数据计算该反应的反应热(6a+5d-4c-12b)kJ•mol-1.
白磷与氧可发生如下反应:P4+5O2=P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P akJ•mol-1、P-O bkJ•mol-1、P=O ckJ•mol-1、O=O dkJ•mol-1根据图示的分子结构和有关数据计算该反应的反应热(6a+5d-4c-12b)kJ•mol-1.
分析 热化学方程式的焓变△H=反应物总键能-生成物总键能,据此计算判断,注意每摩尔P4中含有6molP-P键.
解答 解:各化学键键能为P-P a kJ•mol-1、P-O b kJ•mol-1、P=O c kJ•mol-1、O=O d kJ•mol-1.
反应热△H=反应物总键能-生成物总键能,
所以反应P4+5O2=P4O10的反应热△H=6akJ•mol-1+5dkJ•mol-1-(4ckJ•mol-1+12bkJ•mol-1)=(6a+5d-4c-12b)kJ•mol-1,
故答案为:(6a+5d-4c-12b) kJ•mol-1.
点评 本题考查反应热与焓变的应用,题目难度不大,明确反应热与化学键键能的关系为解答关键,注意从物质能量、键能理解反应热.

练习册系列答案
相关题目
8.用 Zn、Cu片和稀H2SO4组成的原电池装置中,经过一段时间工作后,下列说法正确的是( )
| A. | Zn片是正极,Cu片是负极 | B. | 电流方向是从Zn经外电路流向Cu | ||
| C. | 电解液的PH保持不变 | D. | Cu片上有气泡产生 |
5.天然铊有两种稳定同位素,${\;}_{81}^{203}$Tl和${\;}_{81}^{205}$Tl.下列有关铊的同位素说法中,不正确的是( )
| A. | ${\;}_{81}^{203}$Tl 和 ${\;}_{81}^{205}$Tl 质子数相同 | |
| B. | ${\;}_{81}^{203}$Tl 和 ${\;}_{81}^{205}$Tl互为同素异形体 | |
| C. | ${\;}_{81}^{203}$Tl 和 ${\;}_{81}^{205}$Tl中子数之差为2 | |
| D. | ${\;}_{81}^{205}$Tl 原子核内中子数与核外电子数之差为43 |
12.下列解释事实的方程式不正确的是( )
| A. | NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| B. | 铁盐净水的原理:Fe3++3H2O?Fe(OH)3(胶体)+3H+ | |
| C. | 用少量氨水吸收工业尾气中的SO2:2NH3•H2O+SO2═2NH4++SO32-+H2O | |
| D. | Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-=2Fe2++I2+3H2O |
6.下列反应的离子方程式书写正确的是( )
| A. | 铜和醋酸反应:Cu+2CH3COOH═2CH3COO-+Cu2++H2↑ | |
| B. | 氧化铁与稀盐酸反应:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 锌与硝酸银溶液反应:Zn+Ag+═Zn2++Ag | |
| D. | 稀硝酸和石灰乳反应:H++OH-═H2O |
7.下列各组物质中,互为同分异构体的是( )
| A. | CH3CH2CH2CH2CH3和CH3CH(CH3)2 | B. | CH2=C(CH3)2和CH2=CHCH=CH2 | ||
| C. | O2和O3 | D. | CH3CH2OH和CH3-O-CH3 |