题目内容
 已知如图是常见元素形成的单质或化合物A、B、C、D、E、X转化关系(部分生成物和反应条件略去)
已知如图是常见元素形成的单质或化合物A、B、C、D、E、X转化关系(部分生成物和反应条件略去)(1)若E为氧化物
①当X是碱性盐溶液,C分子中有22个电子时,表示X呈碱性的离子方程式为
②当X为金属单质时,则X与B的稀溶液反应生成C的离子反应方程式为:
(2)若E为单质气体,D为白色沉淀,A的化学式可能是
考点:无机物的推断
专题:推断题
分析:常见元素形成的单质或化合物A、B、C、D、E、X中,
(1)若E为氧化物,①当X是碱性盐溶液,C分子中有22个电子,则C为CO2,氧化物与水反应生成氧化物的,常见的为NO2,所以A为NO2,B为硝酸,硝酸与碳酸盐反应生成22个电子的二氧化碳分子,所以X为碳酸盐;
②X为金属单质时,由转化图可知,应为Fe与稀硝酸反应生成硝酸铁,硝酸铁再与铁反应生成硝酸亚铁,所以C为硝酸铁,D为硝酸亚铁;
(2)若E为单质气体,在常温下能与水反应生成气体单质的,常见的为Na或Na2O2 或NaH,生成B为NaOH,D为白色沉淀,则X可以为铝盐,据此答题.
(1)若E为氧化物,①当X是碱性盐溶液,C分子中有22个电子,则C为CO2,氧化物与水反应生成氧化物的,常见的为NO2,所以A为NO2,B为硝酸,硝酸与碳酸盐反应生成22个电子的二氧化碳分子,所以X为碳酸盐;
②X为金属单质时,由转化图可知,应为Fe与稀硝酸反应生成硝酸铁,硝酸铁再与铁反应生成硝酸亚铁,所以C为硝酸铁,D为硝酸亚铁;
(2)若E为单质气体,在常温下能与水反应生成气体单质的,常见的为Na或Na2O2 或NaH,生成B为NaOH,D为白色沉淀,则X可以为铝盐,据此答题.
解答:
解:常见元素形成的单质或化合物A、B、C、D、E、X中,
(1)若E为氧化物,①当X是碱性盐溶液,C分子中有22个电子,则C为CO2,氧化物与水反应生成氧化物的,常见的为NO2,所以A为NO2,B为硝酸,硝酸与碳酸盐反应生成22个电子的二氧化碳分子,所以X为碳酸盐,碳酸根离子水解,溶液呈碱性,离子方程式为CO32-+H2O HCO3-+OH-,
HCO3-+OH-,
故答案为:CO32-+H2O HCO3-+OH-;
HCO3-+OH-;
②X为金属单质时,由转化图可知,应为Fe与稀硝酸反应生成硝酸铁,硝酸铁再与铁反应生成硝酸亚铁,所以C为硝酸铁,D为硝酸亚铁,铁与硝酸铁反应的离子方程式为Fe+4H++NO3-=Fe3++NO↑+2H2O,
故答案为:Fe+4H++NO3-=Fe3++NO↑+2H2O;
(2)若E为单质气体,在常温下能与水反应生成气体单质的,常见的为Na或Na2O2或NaH,所以A为Na或Na2O2或NaH,生成B为NaOH,D为白色沉淀,则X可以为铝盐,
故答案为:Na或Na2O2或NaH;
(1)若E为氧化物,①当X是碱性盐溶液,C分子中有22个电子,则C为CO2,氧化物与水反应生成氧化物的,常见的为NO2,所以A为NO2,B为硝酸,硝酸与碳酸盐反应生成22个电子的二氧化碳分子,所以X为碳酸盐,碳酸根离子水解,溶液呈碱性,离子方程式为CO32-+H2O
 HCO3-+OH-,
HCO3-+OH-,故答案为:CO32-+H2O
 HCO3-+OH-;
HCO3-+OH-;②X为金属单质时,由转化图可知,应为Fe与稀硝酸反应生成硝酸铁,硝酸铁再与铁反应生成硝酸亚铁,所以C为硝酸铁,D为硝酸亚铁,铁与硝酸铁反应的离子方程式为Fe+4H++NO3-=Fe3++NO↑+2H2O,
故答案为:Fe+4H++NO3-=Fe3++NO↑+2H2O;
(2)若E为单质气体,在常温下能与水反应生成气体单质的,常见的为Na或Na2O2或NaH,所以A为Na或Na2O2或NaH,生成B为NaOH,D为白色沉淀,则X可以为铝盐,
故答案为:Na或Na2O2或NaH;
点评:本题考查无机物的推断,熟悉物质的性质是解答本题的关键,难度中等,答题时注意根据物质的性质结合反应的特点和转化关系解答该题.

练习册系列答案
相关题目
室温下向浓度均为0.1mol?L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积的关系如图所示.下列说法正确的是( )


| A、G点时沉淀的质量为18.5g |
| B、该混合溶液中6c(Fe3+)>c(NO3-) |
| C、该混合溶液在空气中加热、蒸干、灼烧后所得到的固体为Fe(NO3)3和Al(NO3)3 |
| D、室温下Ksp[Al(OH)3]>Ksp[Fe(OH)3] |
用nA表示阿伏伽德罗常数的值.下列说法正确的是( )
| A、28g N2中含有氮原子数为nA |
| B、1molNa与足量O2反应转移的电子数为nA |
| C、常温常压下,22.4LCO2中含有的分子数为nA |
| D、1mol?L-1K2SO4溶液中含有的钾离子数为nA |
胶体区别于其它分散系的实质是( )
| A、胶体粒子直径在1nm-100nm之间 |
| B、胶体可发生丁达尔效应 |
| C、胶体粒子不能透过半透膜 |
| D、胶体粒子能够发生布朗运动 |
对下列物质进行的分类正确的是( )
| A、CuSO4?5H2O属于纯净物 |
| B、凡能电离出H+的化合物均属于酸 |
| C、纯碱、烧碱、碱石灰均属于碱 |
| D、盐类物质一定含有金属元素 |
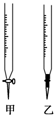 某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步: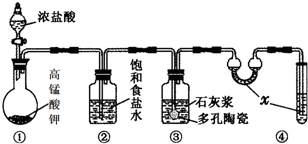 实验室常用以下几种方法制取氯气
实验室常用以下几种方法制取氯气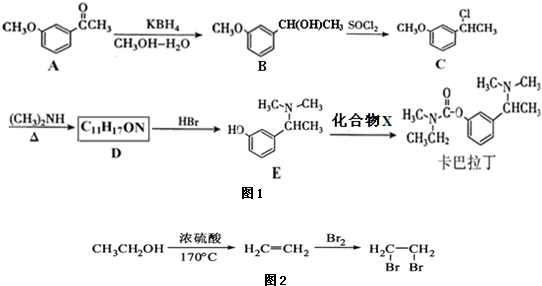
 )和丙酮(
)和丙酮( )制备化合物
)制备化合物 的合成路线流程图(无机试剂任选).合成路线流程图如图2:
的合成路线流程图(无机试剂任选).合成路线流程图如图2:
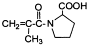 有多种同分异构体,如
有多种同分异构体,如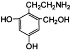 等.写出其中满足下列条件的同分异构体:A.含有苯环,不含甲基;B.能与NaOH溶液以物质的量之比1:1完全中和;C.苯环上一卤代物只有一种,
等.写出其中满足下列条件的同分异构体:A.含有苯环,不含甲基;B.能与NaOH溶液以物质的量之比1:1完全中和;C.苯环上一卤代物只有一种,