题目内容
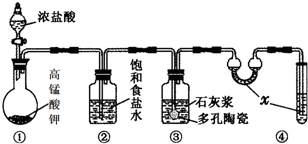 实验室常用以下几种方法制取氯气
实验室常用以下几种方法制取氯气(1)二氧化锰与浓盐酸反应制氯气,写出其反应的离子方程式
(2)高锰酸钾与浓盐酸反应制氯气,写出其反应的化学方程式
(3)氯酸钾与浓盐酸反应制氯气,该反应中氧化产物与还原产物的物质的量之比为
考点:氯气的实验室制法
专题:卤族元素
分析:(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,据此书写离子方程式;
(2)高锰酸钾与浓盐酸反应生成氯化钾、氯化锰、氯气、水,据此书写化学方程式;
(3)根据反应方程式中化合价的变化分析氧化产物与还原产物物质的量.
(2)高锰酸钾与浓盐酸反应生成氯化钾、氯化锰、氯气、水,据此书写化学方程式;
(3)根据反应方程式中化合价的变化分析氧化产物与还原产物物质的量.
解答:
解:(1)二氧化锰与浓盐酸在加热条件下反应生成氯气,化学方程式为MnO2+4HCl
MnCl2+Cl2↑+2H2O,离子方程式为MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
(2)高锰酸钾与浓盐酸反应时,Cl-被氧化成单质氯,而MnO4-被还原成Mn2+,即反应生成氯化钾、氯化锰、氯气、水,由电子守恒及质量守恒定律可知,该反应为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,
故答案为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O;
(3)反应方程式KClO3+6HCl═KCl+3Cl2↑+3H2O中,KClO3中Cl元素化合价由+5价变成0价,化合价降低5价,HCl中氯元素化合价由-1价升高为0价,化合价升高1价,用单线桥表示方程式中标出电子转移的方向和数目为: ,氧化产物与还原产物都是氯气,其中
,氧化产物与还原产物都是氯气,其中
为还原产物、
为氧化产物,则氧化产物与还原产物物质的量之比为
:
=5:1,
故答案为:5:1.
| ||
| ||
故答案为:MnO2+4H++2Cl-
| ||
(2)高锰酸钾与浓盐酸反应时,Cl-被氧化成单质氯,而MnO4-被还原成Mn2+,即反应生成氯化钾、氯化锰、氯气、水,由电子守恒及质量守恒定律可知,该反应为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,
故答案为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O;
(3)反应方程式KClO3+6HCl═KCl+3Cl2↑+3H2O中,KClO3中Cl元素化合价由+5价变成0价,化合价降低5价,HCl中氯元素化合价由-1价升高为0价,化合价升高1价,用单线桥表示方程式中标出电子转移的方向和数目为:
 ,氧化产物与还原产物都是氯气,其中
,氧化产物与还原产物都是氯气,其中| 5 |
| 6 |
| 1 |
| 6 |
| 5 |
| 6 |
| 1 |
| 6 |
故答案为:5:1.
点评:本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,注意氧化还原反应中电子守恒,题目难度不大.

练习册系列答案
相关题目
下列有关的离子方程式书写正确的是( )
| A、氢氧化钡溶液和稀硫酸反应:Ba2++SO42-=BaSO4↓ |
| B、浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑ |
| C、SO2通入溴水中:SO2+Br2+2H2O=SO42-+2Br-+4H+ |
| D、钠放于水中:Na+2H2O=Na++2OH-+H2↑ |
下列说法正确的是( )
A、常温下
| ||
| B、向碳酸氢钙溶液中加入过量氢氧化钠溶液发生反应的离子方程式可表示为:Ca2++HCO3-+OH-═CaCO3↓+H2O | ||
| C、加入铝能放出H2的溶液中一定能大量存在Cu2+、Na+、NO3-、C1?四种离子 | ||
| D、常温下将0.4 mol/L HB溶液和0.2 mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(B-)>c(Na+)>c(H+)>c(OH-) |
 已知如图是常见元素形成的单质或化合物A、B、C、D、E、X转化关系(部分生成物和反应条件略去)
已知如图是常见元素形成的单质或化合物A、B、C、D、E、X转化关系(部分生成物和反应条件略去) .
.
 碳酸钙可以降低胃酸的浓度而被用作胃药的抗酸剂.某中学研究性学习小组为测定一胃药中碳酸钙的含量,设计了如下的实验操作:
碳酸钙可以降低胃酸的浓度而被用作胃药的抗酸剂.某中学研究性学习小组为测定一胃药中碳酸钙的含量,设计了如下的实验操作:
 .化合物
.化合物 是合成抗癌药物美法伦的中间体,请写出以
是合成抗癌药物美法伦的中间体,请写出以 和
和 为原料制备该化合物的合成路线流程图(无机试剂任用).
为原料制备该化合物的合成路线流程图(无机试剂任用).