题目内容
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )
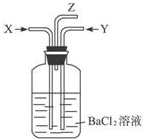
①洗气瓶中产生的沉淀是碳酸钡
②在Z导管出来的气体中无二氧化碳
③洗气瓶中产生的沉淀是硫酸钡
④在Z导管口有红棕色气体出现.

①洗气瓶中产生的沉淀是碳酸钡
②在Z导管出来的气体中无二氧化碳
③洗气瓶中产生的沉淀是硫酸钡
④在Z导管口有红棕色气体出现.
| A、①④ | B、①② | C、②③ | D、③④ |
考点:二氧化硫的化学性质,氮的氧化物的性质及其对环境的影响
专题:
分析:碳与浓硫酸共热产生的X气体为CO2和SO2的混合气体,铜与浓硝酸反应产生的Y气体是NO2,同时通入时因NO2与水和SO2共同作用要产生SO42-和NO,NO在空气中又会生成NO2,以此解答该题.
解答:
解:碳与浓硫酸共热产生的X气体为CO2和SO2的混合气体,铜与浓硝酸反应产生的Y气体是NO2,
SO2+H2O+NO2=H2SO4+NO,故洗气瓶中产生的是硫酸钡沉淀,Z处逸出的气体中有CO2和NO,NO遇到空气中的氧气生成了红棕色的NO2.
故选D.
SO2+H2O+NO2=H2SO4+NO,故洗气瓶中产生的是硫酸钡沉淀,Z处逸出的气体中有CO2和NO,NO遇到空气中的氧气生成了红棕色的NO2.
故选D.
点评:本题考查硝酸、浓硫酸的性质以及二氧化硫与二氧化氮等物质的性质题目难度不大,注意相关元素化合物知识的积累.

练习册系列答案
相关题目
工业上利用可逆反应 N2(g)+3H2(g)?2NH3(g)合成氨,下列叙述正确的是( )
| A、该反应是放热反应,降低温度将缩短反应达到平衡的时间 |
| B、恒温恒容下往平衡体系通入氩气,反应体系的压强会增大,反应速率也必定增大 |
| C、恒温恒压下往平衡体系通入氩气,反应体系的体积会增大,平衡体系朝逆向移动 |
| D、合成氨的适宜条件是高温、高压、催化剂,其中催化剂不改变该反应的逆反应速率 |
与30mL1mol/L的MgCl2溶液中Cl-浓度相同的是( )
| A、150mL0.2mol/LFeCl2溶液 |
| B、90mL2mol/LNaCl溶液 |
| C、60mL1mol/LAlCl3溶液 |
| D、30mL0.5mol/LCaCl2溶液 |
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、1L0.1mol?L-1的氨水中有0.1NA个NH4+ |
| B、标准状况下,22.4L盐酸含有NA个HCl分子 |
| C、常温常压下,14g由N2与CO组成的混合气体含有的原子数目为0.5NA |
| D、标准状况下,6.72LNO2与水充分反应转移的电子数目为0.2NA |
在一个固定容积的密闭容器中,可逆反应:mA(g)+nB(g)?pC(g)+qD(g)中,当m、n、p、q为任意正整数时,达到平衡的标志是( )
| A、体系压强不再发生变化 |
| B、各组分的物质的量浓度不再改变 |
| C、各组分的质量分数不再改变 |
| D、反应速率vA:vB:vC:vD=m:m:p:q |



