题目内容
配制100mL 1.00mol/L NaCl 溶液,下列说法正确的是( )
| A、将所需量的NaCl溶于100mL水中 |
| B、将所需量的NaCl溶于少量水中,再加水定容到100mL |
| C、将所需量的NaCl直接放入容量瓶中,加水定容到100mL |
| D、定容时俯视读刻度 |
考点:配制一定物质的量浓度的溶液
专题:物质的量浓度和溶解度专题
分析:配制100mL 1.00mol/L NaCl 溶液,算出所需的氯化钠的物质的量,然后将所需要量的氯化钠,溶于水配成100ml溶液即可,注意100ml是指溶液的体积.
解答:
解:A.NaCl溶于100mL水中,溶液的体积大于100ml,所配溶液浓度偏小,故A错误;
B.根据浓度公式C=
,将所需量的NaCl溶于少量水中,再加水定容到100mL,所得溶液的体积为100ml,所得溶液的浓度为1.00mol/L,故B正确;
C.容量瓶为精密仪器,不能在容量瓶中稀释或者溶解物质,故C错误;
D.定容时应平视刻度线,如果俯视,则会导致加入的蒸馏水偏多,最终溶液的体积偏大,根据C=
知最终配的溶液浓度偏小,故D错误;
故选B.
B.根据浓度公式C=
| n |
| V |
C.容量瓶为精密仪器,不能在容量瓶中稀释或者溶解物质,故C错误;
D.定容时应平视刻度线,如果俯视,则会导致加入的蒸馏水偏多,最终溶液的体积偏大,根据C=
| n |
| V |
故选B.
点评:本题考查了一定物质的量浓度的溶液的配置,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力,该题的难点在于误差分析,注意对浓度公式中体积的理解,结合浓度公式进行误差分析.

练习册系列答案
相关题目
下列各组溶液在水溶液中能大量共存,且为无色透明的是( )
| A、K+、SO42-、MnO4-、Cl- |
| B、Na+、NO3-、Ba2+、Cl- |
| C、Cu2+、NO3-、Ba2+、OH- |
| D、K+、SO42-、Fe3+、Cl- |
下列离子反应方程式正确的是( )
| A、稀硫酸与氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ |
| B、氢氧化铜和稀盐酸溶液反应:H++OH-═H2O |
| C、锌粒溶于醋酸溶液:Zn+2H+═Zn2++H2↑ |
| D、往盐酸中滴加少量Na2CO3溶液:CO32-+2H+═CO2↑+H2O |
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、1mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA |
| B、标准状况下,22.4L NH3中含有共价键的数目为NA |
| C、1mol Cl2与足量Fe反应转移电子数一定为3NA |
| D、标准状况下,11.2L SO3所含的分子数目为0.5NA |
100mL浓度为2mol/L的盐酸跟过量的锌片反应,为减慢反应速率,又不影响生成氢气的总量,可采用的方法是( )
| A、加入适量NaCl溶液 |
| B、加入适量NaOH溶液 |
| C、加入数滴CuCl2溶液 |
| D、加入适量NaNO3溶液 |

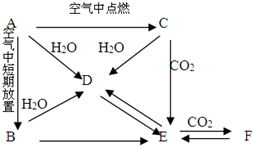 A、B、C、D、E五种物质都含同一种元素,C为一种淡黄色的固体.它们按如图所示的关系相互转化,已知A为单质.分别写出有关反应的化学方程式.
A、B、C、D、E五种物质都含同一种元素,C为一种淡黄色的固体.它们按如图所示的关系相互转化,已知A为单质.分别写出有关反应的化学方程式.