题目内容
铜是人类最早使用的金属,被广泛应用于电气,轻工,机械制造和国防工业等,Cu2O与H2SO4能发生反应:Cu2O+H2SO4═Cu+CuSO4+H2O.
(1)用实验法确定某温度下Cu(OH)2固体的分解产物.称取9.8gCu(OH)2样品,将该样品在坩埚中加热完全分解,冷却至室温后,测得剩余固体质量为7.6g,该固体的成分及质量为 ,若将所得固体溶于足量稀硫酸,所得固体质量为 g.
(2)冰铜(主要含Cu2S和FeS等)式冶炼通的理想材料,高温下利用冰铜冶炼金属铜的反应主要有:
①2Cu2S+3O2
2Cu2O+2SO2和②2Cu2O+Cu2S
6Cu+SO2↑
若得到1mol单质通,反应中转移电子的物质的量为 ,反应②中氧化剂为
(3)用惰性电极电解200mLmol?L-1的CuSO4溶液(点纠结过程中溶液体积变化忽略不计),阴极反应为 ,若阳极收集到标准状况下112mL气体,所得溶液的pH= .
(1)用实验法确定某温度下Cu(OH)2固体的分解产物.称取9.8gCu(OH)2样品,将该样品在坩埚中加热完全分解,冷却至室温后,测得剩余固体质量为7.6g,该固体的成分及质量为
(2)冰铜(主要含Cu2S和FeS等)式冶炼通的理想材料,高温下利用冰铜冶炼金属铜的反应主要有:
①2Cu2S+3O2
| ||
| ||
若得到1mol单质通,反应中转移电子的物质的量为
(3)用惰性电极电解200mLmol?L-1的CuSO4溶液(点纠结过程中溶液体积变化忽略不计),阴极反应为
考点:铜金属及其重要化合物的主要性质
专题:元素及其化合物
分析:(1)根据样品的物质的量,灼烧后铜的质量不变,计算出7.6g固体中铜和氧原子物质的量比值;产生氧化亚铜的同时,会产生氧气,根据氧元素质量守恒,计算出氧化亚铜的物质的量,最后计算出固体铜的质量;
(2)根据氧化还原反应的转移电子数=化合价变化×物质的量来计算,氧化剂根据化合价降低来判断;
(3)用惰性电极电解200mLmol?L-1的CuSO4溶液,阴极反应式为Cu2++2e-=Cu;根据阳极收集到标准状况下112mL气体计算氢离子浓度,再计算pH值.
(2)根据氧化还原反应的转移电子数=化合价变化×物质的量来计算,氧化剂根据化合价降低来判断;
(3)用惰性电极电解200mLmol?L-1的CuSO4溶液,阴极反应式为Cu2++2e-=Cu;根据阳极收集到标准状况下112mL气体计算氢离子浓度,再计算pH值.
解答:
解:(1)9.8gCu(OH)2样品中氢氧化铜物质的量是0.1mol,灼烧若是生成了氧化铜,质量应该是:0.1mol×80g/mol=8g>7.6g,故生成产物含有Cu2O;
生成Cu2O同时生成了氧气,氧气的质量是:8g-7.6g=0.4g,n(O2)=0.0125mol;根据关系式2Cu2O~O2,n(Cu2O)=0.0125mol×2=0.025mol,故
m(Cu2O)=0.025×144=3.6g,则m(CuO)=7.6-3.6=4g,
Cu2O+H2SO4=Cu+CuSO4+H2O
1 1
n(Cu)=n(Cu2O)=0.025mol,
铜的质量是:0.025mol×64g/mol=1.6g;
故答案为:CuO和Cu2O分别为4.0g和3.6g; 1.6;
(2)根据反应①2Cu2S+3O2
2Cu2O+2SO2和②2Cu2O+Cu2S
6Cu+SO2↑
要生成1mol铜则反应①要消耗
mol的Cu2S,故反应①转移的电子数为
mol×6=2mol,反应②要消耗
mol的Cu2S,故反应②转移的电子数为
mol×6=1mol,所以共转移2+1=3mol;再根据化合价降低的为氧化剂则反应②中氧化剂为Cu2O和Cu2S,
故答案:3mol;Cu2O和Cu2S;
(3)用惰性电极电解200mLmol?L-1的CuSO4溶液,阴极反应式为Cu2++2e-=Cu,阳极反应为4OH--4e-=O2↑+4H2O根据收集到标准状况下112mL气体即
=0.005mol,则消耗了氢氧根为0.005mol×4=0.02mol,所以容易中的氢离子为0.02mol,所以氢离子的浓度为
=0.1mol/L,则pH=1;
故答案:Cu2++2e-=Cu;1.
生成Cu2O同时生成了氧气,氧气的质量是:8g-7.6g=0.4g,n(O2)=0.0125mol;根据关系式2Cu2O~O2,n(Cu2O)=0.0125mol×2=0.025mol,故
m(Cu2O)=0.025×144=3.6g,则m(CuO)=7.6-3.6=4g,
Cu2O+H2SO4=Cu+CuSO4+H2O
1 1
n(Cu)=n(Cu2O)=0.025mol,
铜的质量是:0.025mol×64g/mol=1.6g;
故答案为:CuO和Cu2O分别为4.0g和3.6g; 1.6;
(2)根据反应①2Cu2S+3O2
| ||
| ||
要生成1mol铜则反应①要消耗
| 1 |
| 3 |
| 1 |
| 3 |
| 1 |
| 6 |
| 1 |
| 6 |
故答案:3mol;Cu2O和Cu2S;
(3)用惰性电极电解200mLmol?L-1的CuSO4溶液,阴极反应式为Cu2++2e-=Cu,阳极反应为4OH--4e-=O2↑+4H2O根据收集到标准状况下112mL气体即
| 0.112L |
| 22.4L/mol |
| 0.02mol |
| 0.2L |
故答案:Cu2++2e-=Cu;1.
点评:本题考查了铜金属及其重要化合物的性质应用,涉及的知识点较多,充分考查了学生的分析、理解信息能力及计算能力,本题难度稍大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
将一定量xAl2(SO4)3?y(NH4)2SO4?24H2O晶体加入到过量NaOH溶液中,加热生成NH3 0.85g(假如生成的NH3全部逸出),再通入过量的CO2,过滤、洗涤、灼烧,得Al2O3固体2.55g.则x:y=(已知:Al2O3的相对分子质量为102;NH3的相对分子质量为17)( )
| A、1:2 | B、1:1 |
| C、1:4 | D、2:1 |
某有机物其结构简式如图关于该有机物,下列叙述不正确的是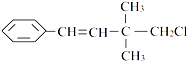 ( )
( )
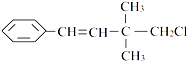 ( )
( )| A、一定条件下,能发生加聚反应 |
| B、能使溴水褪色 |
| C、一定条件下,能发生取代反应 |
| D、能与NaOH的醇溶液共热发生消去反应 |
经测定某种溶液中只含NH4+、Cl-、H+、OH-四种离子,下列说法错误的是( )
| A、若满足:c(Cl-)=c(NH4+)>c(OH-)=c(H+),则溶质一定是NH4Cl |
| B、若满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+),则溶质一定是NH4Cl和NH3-?H2O |
| C、溶液中四种离子之间可能满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| D、若满足:c(NH4+)=c(Cl-),则溶液一定呈中性 |
下列关于淀粉、脂肪、蛋白质的说法中错误的是( )
| A、它们都是生活中常见的高分子化合物 |
| B、它们都是有机化合物 |
| C、它们在一定条件下都能发生水解反应 |
| D、它们都是生物体进行生命活动的能源 |
如图由锌-铜-稀H2SO4组成的原电池装置中,当导线中有0.2mol电子通过时,理论上两极的变化是( )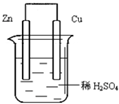

| A、铜片增重6.4g |
| B、锌片增重6.5 g |
| C、铜片上析出0.1 mol O2 |
| D、锌片溶解了6.5 g |
