��Ŀ����
2��ʵ���ҿ���ͭ��Ũ������Ȼ�������������Ʒ�Ӧ��ȡ��������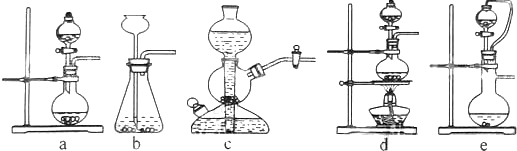
�������������������Ʒ�Ӧ��ȡ��������ϣ���ܿ��Ʒ�Ӧ�ٶȣ�ͼ�п�ѡ�õķ���װ����ae ����д��ĸ����
������������������Ʒ�Ӧ��ȡ3.36L����״�������������������40%�������ƣ��������������������������ƣ����������ȡ����������31.5 g ������һλС������
��ij�ȵ糧�Ͽմ��������������������س��꣬�ֶԸ�������ˮ��Ʒ����̽����������pH��ֽ�ⶨ��ˮ��Ʒ��pH����������Ϊȡһ����ֽ���ڸ���ྻ�ı�������Ƭ���ϣ��ø���ྻ�IJ�����պȡ��ˮ��Ʒ������ֽ���룬����ɫ������ձ���ɫ�������������ƷpHԼΪ3��Ϊ��һ��̽����SO2���γ���������ʣ���һ������SO2ͨ������ˮ�У����pHΪ3����Һ��Ȼ����Һ��ΪA��B���ݣ�����ҺB�����ڿ����У����ܱձ����A��ȣ����ú����ҺB��ˮ�ĵ���̶Ƚ���С�����������С�����䡱����
���� �������������������ȡSO2���Լ�Ϊ��̬��Һ̬����Ӧ����������ȣ���ͨ������������������������Ʒ�Ӧ���ʣ�
�������غ�ɵã�Na2SO3��SO2�����ݹ�ϵʽ��������������ʵ����������Ҫ�������Ƶ�����������������Ƶ������������ټ������Ҫ���ʺ���������Ƶ�������
�۲ⶨpH�����ò�����պȡ��Һ��Ȼ�����ɫ���Աȣ�����ҺB�����ڿ����У������ᱻ�����������ᣬ��Һ������ǿ��
��� �⣺����������������Ʒ�Ӧ��ȡ��������ϣ���ܿ��Ʒ�Ӧ�ٶȣ����ڷ�Ӧ����Ҫ���ȣ��ų�װ��d����������������ϸС����������ѡ��װ��c��װ��b����֪��Ӧ���ʣ��ʿ�ѡ�õķ���װ��Ϊ��ae��
�ʴ�Ϊ��ae��
�������غ�ɵã�Na2SO3��SO2��������������Ƶ�����Ϊ��m��Na2SO3��=126g•mol-1��$\frac{3.36L}{22.4L/mol}$=18.9g��
�������40%�������ƣ��������������������������ƣ����������Ƶ���������Ϊ60%��
�������ȡ���������Ƶ�����Ϊ$\frac{18.9g}{60%}$=31.5g��
�ʴ�Ϊ��31.5��
�۲ⶨpH�����ò�����պȡ��Һ��Ȼ�����ɫ���Աȣ���������Ϊȡһ����ֽ���ڸ���ྻ�ı�������Ƭ���ϣ��ø���ྻ�IJ�����պȡ��ˮ��Ʒ������ֽ�ϣ�����ɫ���������ձ���ɫ��������
����ҺB�����ڿ����У������ᱻ�����������ᣬ��Һ������ǿ����ˮ�ĵ���̶ȼ�С��
�ʴ�Ϊ��ȡһ����ֽ���ڸ���ྻ�ı�������Ƭ���ϣ��ø���ྻ�IJ�����պȡ��ˮ��Ʒ������ֽ���룬����ɫ������ձ���ɫ����������С��
���� ���⿼��Ũ����Ļ�ѧ���ʣ�Ϊ��Ƶ���㣬��Ŀ�ѶȲ�����ȷ��ѧʵ����������������������巢��װ���ص�Ϊ���ؼ���ע����ȷŨ��������ʣ�������ؿ���ѧ���Ļ�ѧʵ��������

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�| A�� | 7.5 mL 2mol/L MgCl2��Һ | B�� | 30 mL 1mol/L KCl��Һ | ||
| C�� | 10 mL 3mol/L NaCl��Һ | D�� | 30 mL 0.5 mol/L AlCl3��Һ |
| A�� | 4�� | B�� | 5�� | C�� | 6�� | D�� | 7�� |
| A�� | ��Һ��PH���� | B�� | ��Һ�е�Zn2+Ũ������ | ||
| C�� | ��Һ�е�SO42- Ũ������ | D�� | ��Һ���ܶ����� |
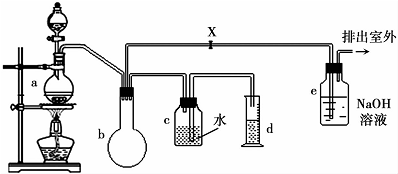
��֪һ�ȼ���IJ����������£�
| ���� | �۵� | �е� | �ܽ��� |
| һ�ȼ��� | -97.73�� | -24.2�� | 18��ʱ��ˮ���ܣ������ѡ���ͪ���ܣ��������Ҵ� |
��1��������Ȼ�����ȣ��״��Ȼ������ŵ��ǻ�������Ʒ��ԭ�������ʸߣ�
��2��a��ZnCl2�����ڼ������������ټӷ�ʯ�Է����У��������һ��ʱ��������ǼӴ�Ƭ��Ӧ�ò�ȡ����ȷ������b������ȷ�𰸱�ţ���
a���������� b����ȴ�� c�����貹�� d����������
��3��װ��b����������Բ����ƿ�������Ƿ�ֹ����������������ȫƿ�ȣ�
��4�������Ȼ���������CCl4��ˮ��Ϻ��÷�Һ©�����룬CCl4���¿ڷų�����Ͽڵ��������¿ڷų�������
��5�������������CH3Cl�ķ�������e���ݳ��ڵ�ȼCH3Cl���壬���������ɫ����������ȼ���������������𣩣�CH3Clȼ�յĻ�ѧ����ʽ��2CH3Cl+3O2$\frac{\underline{\;��ȼ\;}}{\;}$2CO2+2HCl+2H2O��
��6��ijѧ���ڹرջ���x�����������ʵ��ʱ���֣��ռ���һ�������������������ĵļ״���Ũ����Ļ��Һ��������������¶ࣨװ�õ�������û�����⣩����ԭ���Ǽ״��������е��Ȼ��ⶼ���ӷ������ʣ��ڼ���ʱ�ӷ�ʹ��һ�ȼ���IJ����½�
��7��ʵ�������d���ռ�����Һ���к���һ�ȼ��顢�״������ᣮ
��8���״���һ�������»������ɶ����ѣ�������ֱ��ȼ�ϵ�ؾ��������졢Ч�ʸߵ��ŵ㣬�������ܶȸ��ڼ״���E=5.39kW•h•kg-1��ֱ��ȼ�ϵ�ص������ܶȣ��������Ϊ���ԣ�������ֱ��ȼ�ϵ�ص����������ѹΪ1.20V�������ܶ�E=8.64kW•h•kg-1
����֪�����ܶ�E=����������/ȼ��������lkW•h=3.6��l06J�����ӵ���Ϊ1.6��10 -19C��NAΪ6.02��l023mol-l��
| A�� | �Ľ�����β���������������ٴ�����Ⱦ����ŷ� | |
| B�� | ������������Դ�����ٻ�ʯȼ�ϵ�ʹ�� | |
| C�� | ���ȿ��ɿ�����Դ���ٽ��ط����÷�չ | |
| D�� | ��ǿ�Թ�ҵ�����ϡ����������������� |
| A�� | ��֪S��g��+O2��g���TSO2��g����H1��S��s��+O2��g���TSO2��g����H2�����H1����H2 | |
| B�� | HCl��NaOH��Ӧ���к��ȡ�H=-57.3kJ•mol-1����H2SO4��Ba��OH��2��Ӧ���к��ȡ�H=2����-57.3��kJ•mol-1 | |
| C�� | ��֪C��ʯī��s��=C�����ʯ��s����H��0������ʯ��ʯī�ȶ� | |
| D�� | ������ȼ����Ϊ285.5 kJ•mol-1����ˮ�ֽ���Ȼ�ѧ����ʽΪ��2H2O��l���T2H2��g��+O2��g����H=+285.5 kJ•mol-1 |
| A�� | Na | B�� | K | C�� | Mg | D�� | Al |