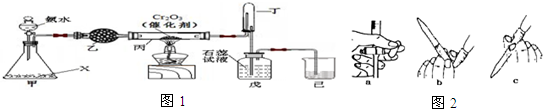
题目内容
18.将 0.1L 含有 0.02mol CuSO4 和 0.01molNaCl 的水溶液用惰性电极电解.电解一段时间后,一个电极上得到 0.01mol Cu,另一电极析出的气体( )| A. | 只有 Cl2 | B. | 既有 Cl2 又有 O2 | ||
| C. | 只有 O2 | D. | 只有 H2 |
分析 阴极电极反应:Cu2++2e-=Cu,Cu在阴极析出,溶液中含有n(Cu2+)=0.02mol,用惰性电极电解,电解一段时间后得到0.01mol Cu,铜离子未完全放电;
阳极发生氧化反应,首先发生反应:2Cl--2e-=Cl2↑,根据电子转移守恒判断是否发生反应:4OH--4e-=2H2O+O2↑,确定气体组成.
解答 解:阴极电极反应:Cu2++2e-=Cu,Cu在阴极析出,溶液中含有n(Cu2+)=0.02mol,用惰性电极电解,电解一段时间后得到0.01mol Cu,铜离子未完全放电,获得电子为0.01mol×2=0.02mol;
阳极发生氧化反应,首先发生反应:2Cl--2e-=Cl2↑,溶液n(Cl-)=0.01mol,氯离子完全放电,失去电子为0.01mol,小于0.02mol,故阳极还发生反应:4OH--4e-=2H2O+O2↑,则阳极析出的气体为既有Cl2又有O2,
故选:B.
点评 本题考查电解原理及有关计算,根据电子守恒结合离子放电顺序判断,侧重考查学生分析计算能力.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
9.下列除去杂质的操作方法不正确的是( )
| A. | 镁粉中含少量铝粉:加足量氢氧化钠溶液充分搅拌后过滤 | |
| B. | 碳酸钠溶液中含少量碳酸氢钠:加足量澄清石灰水 | |
| C. | 自来水中含少量Fe3+:蒸馏 | |
| D. | 硝酸钾固体中含少量氯化钾:配制80℃的饱和溶液,冷却、结晶、过滤、洗涤干燥 |
6.有一铁粉和氧化铜的混合物8.32g,进行如下实验:

根据实验所得数据,有关说法正确的是( )

根据实验所得数据,有关说法正确的是( )
| A. | 无色气体的质量为0.2g | |
| B. | 原混合物中铁的质量为7.0g | |
| C. | 反应后的溶液中金属离子物质的量为0.1 mol | |
| D. | 反应消耗的H2SO4物质的量为0.15 mol |
13.实验室欲用Na2CO3•10H20晶体配制1mol/L的Na2CO3溶液100mL,下列说法正确的是( )
| A. | 要完成实验需称取10.6gNa2CO3•10H20晶体 | |
| B. | 本实验需用到的仪器只有药匙、玻璃棒、烧杯、胶头滴管和100 mL容量瓶 | |
| C. | 配制时若容量瓶不干燥,含有少量蒸馏水会导致浓度偏低 | |
| D. | 定容时用胶头滴管滴人的蒸馏水滴在容量瓶内部刻度线上方会导致浓度偏低 |
3.利用光伏并网发电装置电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极,CO(NH2)2中的氮元素显-3价).
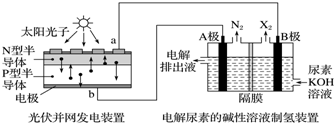
下列叙述中正确的是( )

下列叙述中正确的是( )
| A. | 工作时,A极的电极上CO(NH2)2放电生成N2反应为还原反应 | |
| B. | 工作时,B极的电极反应式为2H2O+2e-═2OH-+H2↑ | |
| C. | N型半导体为正极,P型半导体为负极 | |
| D. | 制氢装置溶液中电子流向:从B极流向A极 |
10.下列除杂的操作方法不正确的是( )
| A. | NO中有少量的NO2:通过装有水的洗气瓶 | |
| B. | SO2中混有少量HCl气体:通过饱和NaHSO3溶液洗气 | |
| C. | O2中有少量的CO2:通过装有碱石灰的U形管 | |
| D. | 食盐中有少量的NaHCO3:加过量的烧碱溶液后加热蒸干 |
7.在1.52g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成气体X,再向所得溶液中加入足量的NaOH溶液,生成2.54g沉淀,则下列表示气体X组成的选项中合理的是( )
| A. | 0.03molNO、0.01molNO2 | B. | 0.03molNO2、0.01molNO | ||
| C. | 0.06molNO | D. | 0.03molNO2 |
 .
.