题目内容
1.表是某人在医院血液生化检查时,化验单的部分内容:| 项目名称 | 数据 | 参考值 |
| 尿素氮 | 3.95 | 2.00-6.10 m mol•L-1 |
| 葡萄糖 | 4.50 | 3.89-6.11 m mol•L-1 |
| 总胆固醇 | 3.80 | <5.20 m mol•L-1 |
| 甘油三酯 | 1.85↑ | <1.70 m mol•L-1 |
(1)这个人的血糖含量属正常(填“正常”、“偏高”或“偏低”)
(2)这个人的1mL血液中含葡萄糖8.1×10-4 g.
分析 血液中葡萄糖的浓度为4.50mmol•L-1,根据参考值判断是否正常,结合M(C6H12O6)=180g/mol,m=nM计算即可.
解答 解:(1)这个人的血糖含量4.50mmol•L-1,在3.89-6.11 mmol•L-1范围之内,血糖含量属于正常,
故答案为:正常;
(2)血液中葡萄糖的浓度为4.50mmol•L-1,M(C6H12O6)=180g/mol,则1mL血液中含葡萄糖质量为1×10-3L×4.50×10-3mol•L-1×180g/mol=8.1×10-4g,
故答案为:8.1×10-4.
点评 本题考查物质的量的相关计算,侧重于学生的分析能力和计算能力的考查,注意把握相关计算公式以及相关单位,为易错点,难度不大.

练习册系列答案
相关题目
9.下列有关硫及其化合物的说法正确的是( )
| A. | 硫单质在过量的空气中燃烧生成SO3 | |
| B. | 自然界的硫元素主要以硫单质、硫化物和硫酸盐等形式存在 | |
| C. | 二氧化硫和氯气使品红溶液褪色的原理相同 | |
| D. | 浓硫酸与碳在一定条件下的反应,体现了浓硫酸的强氧化性与酸性 |
16.下列叙述中,不正确的是( )
| A. | Cl2的摩尔质量为71 | |
| B. | 12C、13C、14C是碳元素的三种核素,互称为同位素 | |
| C. | 0.012kg12C中所含的原子数称为阿伏加德罗常数 | |
| D. | 卢瑟福根据α粒子散射实验,提出了带核的原子结构模型 |
13.盐A与酸B反应,可放出气体C,C与NaOH反应生成A;C最终可氧化生成D;D溶于水生成B,则A、B分别是( )
| A. | Na2S和HCl | B. | Na2CO3和H2SO4 | C. | NaHCO3和HCl | D. | Na2SO3和 H2SO4 |
10.下列分子式只表示一种物质的是( )
| A. | C2H6 | B. | C2H4O2 | C. | C2H6O | D. | C2H4Cl2 |
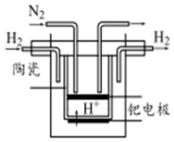 氮的固定对工农业及人类生存具有重大意义.
氮的固定对工农业及人类生存具有重大意义. .
.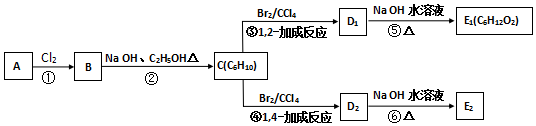
 ,C的化学名称为2,3-二甲基-1,3-丁二烯,E2的结构简式是
,C的化学名称为2,3-二甲基-1,3-丁二烯,E2的结构简式是 ,②的反应类型是消去反应.
,②的反应类型是消去反应. +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$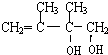 +2NaBr.
+2NaBr.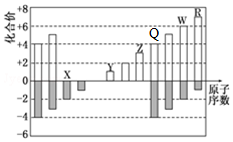 部分短周期元素化合价与原子序数的关系可用图表示.
部分短周期元素化合价与原子序数的关系可用图表示.