题目内容
9.下列有关硫及其化合物的说法正确的是( )| A. | 硫单质在过量的空气中燃烧生成SO3 | |
| B. | 自然界的硫元素主要以硫单质、硫化物和硫酸盐等形式存在 | |
| C. | 二氧化硫和氯气使品红溶液褪色的原理相同 | |
| D. | 浓硫酸与碳在一定条件下的反应,体现了浓硫酸的强氧化性与酸性 |
分析 A.不论氧气是否过量均生成SO2;
B.自然界中含有硫单质、硫化物、硫酸盐;
C.氯气的漂白原理:氯气与水反应生成次氯酸,次氯酸具有强氧化性;二氧化硫的漂白原理:有色物质结合成无色物质;
D.浓硫酸与非金属单质反应只体现浓硫酸的强氧化性.
解答 解:A.不论氧气是否过量均生成SO2,故A错误;
B.硫在地壳中主要以硫化物、硫酸盐等形式存在,火山口处有硫单质,故B正确;
C.氯气与水反应生成次氯酸,次氯酸具有强氧化性,使品红氧化褪色;二氧化硫与有色物质结合成无色物质,使品红褪色,两者漂白原理不同,故C错误;
D.浓硫酸与非金属单质反应只体现浓硫酸的强氧化性,未体现酸性,故D错误;
故选B.
点评 本题考查了物质性质、反应现象和反应原理,物质存在形式等知识点,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
19.CO2通入下列溶液中,不可能产生沉淀的是( )
| A. | 饱和Na2CO3溶液 | B. | 石灰水 | C. | CaCl2溶液 | D. | Ba(OH)2溶液 |
20.目前世界上用量最大,用途最广的合金是( )
| A. | 铝合金 | B. | 青铜 | C. | 钢铁 | D. | 塑钢 |
4.下列各组分子中,都属于含极性键的非极性分子的是( )
| A. | CO2 H2S | B. | C2H4 BF3 | C. | C60 C2H4 | D. | NH3 HCl |
14.下列变化过程中,没有发生化学变化的是( )
| A. | 铁的钝化 | B. | 光合作用 | C. | 碘的升华 | D. | 燃放烟花 |
1.表是某人在医院血液生化检查时,化验单的部分内容:
已知:1摩尔(mol)等于1000毫摩尔(m mol),血液中葡萄糖简称血糖,分子式为C6H12O6,请根据以上信息回答下列问题:
(1)这个人的血糖含量属正常(填“正常”、“偏高”或“偏低”)
(2)这个人的1mL血液中含葡萄糖8.1×10-4 g.
| 项目名称 | 数据 | 参考值 |
| 尿素氮 | 3.95 | 2.00-6.10 m mol•L-1 |
| 葡萄糖 | 4.50 | 3.89-6.11 m mol•L-1 |
| 总胆固醇 | 3.80 | <5.20 m mol•L-1 |
| 甘油三酯 | 1.85↑ | <1.70 m mol•L-1 |
(1)这个人的血糖含量属正常(填“正常”、“偏高”或“偏低”)
(2)这个人的1mL血液中含葡萄糖8.1×10-4 g.
18.下列关于证明醋酸是弱电解质的实验方法不正确的是( )
| A. | 常温下,测定0.1mol•L-1CH3COOH的pH值,若pH大于1,即可证明为弱电解质 | |
| B. | 等体积的0.1mol•L-1HCl和0.1mol•L-1醋酸溶液,分别与等量的相同颗粒度的Zn反应,观察产生气泡的速率,即可证明 | |
| C. | 等体积的0.1mol•L-1HCl和 0.1mol•L-1醋酸溶液,比较中和这两种酸所需相同物质的量浓度的NaOH溶液的体积,即可证明 | |
| D. | 常温下,测一定浓度的CH3COONa溶液的pH值,若pH大于7,即可证明 |
4.如图表示反应:A(g)+B(g)?nC(g)△H<0在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线.下列有关叙述正确的是( )

| A. | a表示有催化剂,b表示无催化剂 | B. | 若其他条件相同,a比b的温度高 | ||
| C. | 反应由逆反应开始 | D. | a→b采用的是加压 |
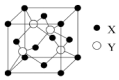 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1;元素Y基态原子的3p轨道上有5个电子;元素Z的原子最外层电子数是其内层电子数的3倍;元素W基态原子的核外电子共有16种运动状态.
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1;元素Y基态原子的3p轨道上有5个电子;元素Z的原子最外层电子数是其内层电子数的3倍;元素W基态原子的核外电子共有16种运动状态.