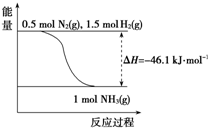
题目内容
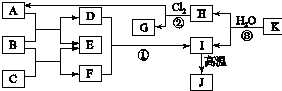 如图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源、燃料,J是一种耐高温材料且是两性氧化物,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出).
如图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源、燃料,J是一种耐高温材料且是两性氧化物,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出).请按要求回答:
(1)写出B的化学式
(2)B与A反应的离子方程式为
(3)反应②为取代反应,其进行的条件是
(4)写出B与C溶液反应的离子方程式
(5)反应③的化学方程式为
(6)用电子式表示M(M是A与Mg反应生成的化合物)
(7)写出反应①的离子方程式为
考点:无机物的推断
专题:推断题
分析:H、G是正四面体结构的非极性分子,H是一种重要的能源、燃料,则H为甲烷,结合反应②可知G为CCl4,A为HCl;
J是耐高温材料且是两性氧化物,则J是Al2O3,B是金属,金属和酸反应生成盐和氢气,C是重要的化工原料,C和金属反应生成氢气和盐,则B是Al、C为NaOH,E是H2、D为AlCl3、F为NaAlO2,AlCl3和NaAlO2发生双水解反应生成Al(OH)3和NaCl,Al(OH)3分解生成Al2O3,所以I为Al(OH)3,K是由两种常见元素组成的化合物,且和水反应生成甲烷和Al(OH)3,根据元素守恒知,K为Al4C3,再结合题目分析解答.
J是耐高温材料且是两性氧化物,则J是Al2O3,B是金属,金属和酸反应生成盐和氢气,C是重要的化工原料,C和金属反应生成氢气和盐,则B是Al、C为NaOH,E是H2、D为AlCl3、F为NaAlO2,AlCl3和NaAlO2发生双水解反应生成Al(OH)3和NaCl,Al(OH)3分解生成Al2O3,所以I为Al(OH)3,K是由两种常见元素组成的化合物,且和水反应生成甲烷和Al(OH)3,根据元素守恒知,K为Al4C3,再结合题目分析解答.
解答:
解:H、G是正四面体结构的非极性分子,H是一种重要的能源、燃料,则H为甲烷,结合反应②可知G为CCl4,A为HCl;
J是耐高温材料且是两性氧化物,则J是Al2O3,B是金属,金属和酸反应生成盐和氢气,C是重要的化工原料,C和金属反应生成氢气和盐,则B是Al、C为NaOH,E是H2、D为AlCl3、F为NaAlO2,AlCl3和NaAlO2发生双水解反应生成Al(OH)3和NaCl,Al(OH)3分解生成Al2O3,所以I为Al(OH)3,K是由两种常见元素组成的化合物,且和水反应生成甲烷和Al(OH)3,根据元素守恒知,K为Al4C3,
(1)通过以上分析知,B为Al,元素Al在元素周期表中的位置是第三周期第IIIA族,G的电子式为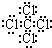 ,故答案为:Al;第三周期第IIIA族;
,故答案为:Al;第三周期第IIIA族; ;
;
(2)A是盐酸、B是Al,二者反应的离子方程式为2Al+6H+=2Al3++3H2↑,故答案为:2Al+6H+=2Al3++3H2↑;
(3)反应②为取代反应,其进行的条件是光照,而为了能得到更多的G,氯气必须过量,故答案为:光照;过量;
(4)Al和NaOH溶液反应生成偏铝酸钠和氢气,所以该反应的离子方程式2OH-+2Al+2H2O=2AlO2-+3H2↑,故答案为:2OH-+2Al+2H2O=2AlO2-+3H2↑;
(5)碳化铝和水反应生成氢氧化铝和甲烷,所以反应③的化学方程式为Al4C3+12H2O=4Al(OH)3↓+3CH4↑,故答案为:Al4C3+12H2O=4Al(OH)3↓+3CH4↑;
(6)M是A与Mg反应生成的化合物为MgCl2,Mg原子和Cl原子通过得失电子生成离子键,其形成过程为 ,
,
故答案为: ;
;
(7)氯化铝和偏铝酸钠反应生成氢氧化铝和氯化钠,离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓,故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓.
J是耐高温材料且是两性氧化物,则J是Al2O3,B是金属,金属和酸反应生成盐和氢气,C是重要的化工原料,C和金属反应生成氢气和盐,则B是Al、C为NaOH,E是H2、D为AlCl3、F为NaAlO2,AlCl3和NaAlO2发生双水解反应生成Al(OH)3和NaCl,Al(OH)3分解生成Al2O3,所以I为Al(OH)3,K是由两种常见元素组成的化合物,且和水反应生成甲烷和Al(OH)3,根据元素守恒知,K为Al4C3,
(1)通过以上分析知,B为Al,元素Al在元素周期表中的位置是第三周期第IIIA族,G的电子式为
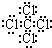 ,故答案为:Al;第三周期第IIIA族;
,故答案为:Al;第三周期第IIIA族;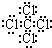 ;
;(2)A是盐酸、B是Al,二者反应的离子方程式为2Al+6H+=2Al3++3H2↑,故答案为:2Al+6H+=2Al3++3H2↑;
(3)反应②为取代反应,其进行的条件是光照,而为了能得到更多的G,氯气必须过量,故答案为:光照;过量;
(4)Al和NaOH溶液反应生成偏铝酸钠和氢气,所以该反应的离子方程式2OH-+2Al+2H2O=2AlO2-+3H2↑,故答案为:2OH-+2Al+2H2O=2AlO2-+3H2↑;
(5)碳化铝和水反应生成氢氧化铝和甲烷,所以反应③的化学方程式为Al4C3+12H2O=4Al(OH)3↓+3CH4↑,故答案为:Al4C3+12H2O=4Al(OH)3↓+3CH4↑;
(6)M是A与Mg反应生成的化合物为MgCl2,Mg原子和Cl原子通过得失电子生成离子键,其形成过程为
 ,
,故答案为:
 ;
;(7)氯化铝和偏铝酸钠反应生成氢氧化铝和氯化钠,离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓,故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓.
点评:本题以Al、Cl及其化合物为载体考查了无机物推断,涉及离子方程式书写、物质结构等知识点,以分子结构、物质用途、物质性质为突破口进行推断,以碳化钙和水反应生成乙炔为例采用知识迁移的方法推断K物质,为易错点.

练习册系列答案
相关题目
下列化学反应中反应速率最大的是( )
| A、25℃时1g镁投入100ml 0.5mol/L盐酸溶液中 |
| B、25℃时1g镁投入200ml 0.5mol/L盐酸溶液中 |
| C、25℃时1g镁投入50ml 1mol/L盐酸溶液中 |
| D、50℃时1g镁投入10ml 1mol/L盐酸溶液中 |
实验室中要配制2mol/L的NaCl溶液980ml,配制时应选用的容量瓶的规格和称取的NaCl的质量分别是( )
| A、980 ml,114.7g |
| B、500ml,58.5g |
| C、1000 ml,117 g |
| D、1000ml,117.0g |
 )与苯炔(
)与苯炔( )反应生成化合物X(立体对称图形),如图所示:
)反应生成化合物X(立体对称图形),如图所示: