题目内容
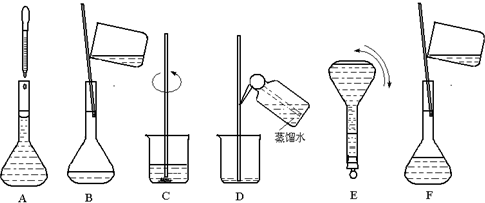
(1)指出使用下列仪器 (已洗净)或用品的第一步操作:
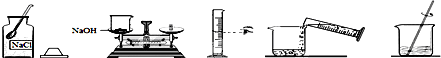
(2)配制物质的量浓度为0.2mol/LNaOH溶液500mL,请回答下列问题:
用托盘天平称取固体样品时 (1g 以下使用游码),若将样品放在了天平的右盘,读数为10.5g,则所称样品的实际质量为 g.
(3)下列操作对配制的NaOH溶液浓度有偏低影响的是 .
A.称量时将NaOH固体直接放在天平托盘上面的纸上
B.将称量的NaOH固体露置在空气的时间过长
C.选用的容量瓶内有少量的蒸馏水
D.在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
E.整个配制过程中容量瓶不振荡.
| 淀粉-KI试纸检验气体 | 集气瓶收集氨气 | 容量瓶 |
| 应称量NaOH的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器 |
| 烧杯、玻璃棒、药匙 |
(3)下列操作对配制的NaOH溶液浓度有偏低影响的是
A.称量时将NaOH固体直接放在天平托盘上面的纸上
B.将称量的NaOH固体露置在空气的时间过长
C.选用的容量瓶内有少量的蒸馏水
D.在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
E.整个配制过程中容量瓶不振荡.
考点:溶液的配制
专题:实验题
分析:(1)用淀粉-KI试纸气体的氧化性,需先用蒸馏水湿润试纸,溶解气体.
溶氨气极易溶于水,收集氨气的集气瓶应干燥.
溶液配制需反复颠倒摇匀,使用前要检查容量瓶是否漏水.
(2)根据m=c?V计算配制0.2mol/L的NaOH溶液500mL需要氢氧化钠的质量,根据所配制的溶液的体积来选择容量瓶的规格,
根据实验实际操作步骤选择所需要的仪器,进而判断缺少的仪器.
(3)分析操作对溶质的物质的量、溶液体积的影响,根据c=
分析判断操作对所配溶液浓度的影响.
溶氨气极易溶于水,收集氨气的集气瓶应干燥.
溶液配制需反复颠倒摇匀,使用前要检查容量瓶是否漏水.
(2)根据m=c?V计算配制0.2mol/L的NaOH溶液500mL需要氢氧化钠的质量,根据所配制的溶液的体积来选择容量瓶的规格,
根据实验实际操作步骤选择所需要的仪器,进而判断缺少的仪器.
(3)分析操作对溶质的物质的量、溶液体积的影响,根据c=
| n |
| V |
解答:
解:(1)用石蕊试纸检验气体的酸碱性,需先用蒸馏水湿润试纸,溶解气体.
溶液配制需反复颠倒摇匀,使用前要检查容量瓶是否漏水.
氨气极易溶于水,收集氨气的集气瓶应干燥,收集前先干燥集气瓶.
故答案为:用蒸馏水湿润;检查容量瓶是否漏水;干燥集气瓶.
(2)配制0.2mol/L的NaOH溶液500mL需要氢氧化钠的质量为:0.2mol/L×0.5L×40g/mol=4.0g;
配制的NaOH溶液500mL,故选用500ml容量瓶;
验具体操作步骤有:计算、称量、溶解、冷却、移液、洗涤移液、定容、摇匀等,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水),用玻璃棒搅拌,冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹面与刻度线水平相切,盖好瓶塞,摇匀.
所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、500ml容量瓶、胶头滴管、筒量(可用、也可不用).
所缺少的仪器为:500ml容量瓶、胶头滴管、筒量(可用、也可不用).
读数为10.5g,则砝码为10g,游码为0.5g,由于将样品放在了天平的右盘,故m物=m砝+m游=10g-0.5g=9.5g,故实际药品的质量为9.5g.
故答案为:4.0;500ml容量瓶;500ml容量瓶、胶头滴管、筒量(可用、也可不用);9.5g.
(3)A、称量NaOH固体时直接放在天平托盘上面的纸上,会导致氢氧化钠潮解,实际称量的氢氧化钠的质量减小,所配溶液浓度偏低,故A符合;
B.将称量的NaOH固体露置在空气的时间过长,会导致氢氧化钠潮解等,实际称量的氢氧化钠的质量减小,所配溶液浓度偏低,故B符合;
C.溶液配制需加水定容,选用的容量瓶内有少量的蒸馏水对所配溶液浓度无影响,故C不符合;
D.在烧杯中溶解NaOH后,没有冷却至室温,立即将所得溶液注入容量瓶中定容,溶液具有热胀冷缩的性质,冷却后所配溶液的体积偏小,使配制溶液的浓度偏高,故D不符合;
E.整个配制过程中容量瓶不振荡,先加入的是密度较大的NaOH溶液,后加入的洗涤烧杯和玻璃棒的溶液密度较小,造成溶液密度不均匀,如果摇均匀密度大的和密度小的相溶体积会比二者原体积之和小,所配制溶液浓度偏大,故E错误;
故选AB.
溶液配制需反复颠倒摇匀,使用前要检查容量瓶是否漏水.
氨气极易溶于水,收集氨气的集气瓶应干燥,收集前先干燥集气瓶.
故答案为:用蒸馏水湿润;检查容量瓶是否漏水;干燥集气瓶.
(2)配制0.2mol/L的NaOH溶液500mL需要氢氧化钠的质量为:0.2mol/L×0.5L×40g/mol=4.0g;
配制的NaOH溶液500mL,故选用500ml容量瓶;
验具体操作步骤有:计算、称量、溶解、冷却、移液、洗涤移液、定容、摇匀等,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水),用玻璃棒搅拌,冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹面与刻度线水平相切,盖好瓶塞,摇匀.
所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、500ml容量瓶、胶头滴管、筒量(可用、也可不用).
所缺少的仪器为:500ml容量瓶、胶头滴管、筒量(可用、也可不用).
读数为10.5g,则砝码为10g,游码为0.5g,由于将样品放在了天平的右盘,故m物=m砝+m游=10g-0.5g=9.5g,故实际药品的质量为9.5g.
故答案为:4.0;500ml容量瓶;500ml容量瓶、胶头滴管、筒量(可用、也可不用);9.5g.
(3)A、称量NaOH固体时直接放在天平托盘上面的纸上,会导致氢氧化钠潮解,实际称量的氢氧化钠的质量减小,所配溶液浓度偏低,故A符合;
B.将称量的NaOH固体露置在空气的时间过长,会导致氢氧化钠潮解等,实际称量的氢氧化钠的质量减小,所配溶液浓度偏低,故B符合;
C.溶液配制需加水定容,选用的容量瓶内有少量的蒸馏水对所配溶液浓度无影响,故C不符合;
D.在烧杯中溶解NaOH后,没有冷却至室温,立即将所得溶液注入容量瓶中定容,溶液具有热胀冷缩的性质,冷却后所配溶液的体积偏小,使配制溶液的浓度偏高,故D不符合;
E.整个配制过程中容量瓶不振荡,先加入的是密度较大的NaOH溶液,后加入的洗涤烧杯和玻璃棒的溶液密度较小,造成溶液密度不均匀,如果摇均匀密度大的和密度小的相溶体积会比二者原体积之和小,所配制溶液浓度偏大,故E错误;
故选AB.
点评:考查一定物质的量浓度溶液配制等,难度不大,注意根据根据c=
理解溶液配制与误差分析.
| n |
| V |

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
以下关于金属的金属性的判断正确的是( )
| A、镁和铝与同浓度的盐酸反应铝没镁反应剧烈,所以铝比镁的金属性强 |
| B、Mg(OH)2溶液的碱性比NaOH溶液的碱性弱,所以镁比钠的金属性强 |
| C、铁能从CuSO4溶液中置换出铜,所以铁比铜的金属性强 |
| D、电解含Ag+和Cu2+的溶液时,Ag+优先放电,所以银比铜的金属性强 |
 液,试画出原电池的装置图,并说明其工作原理.
液,试画出原电池的装置图,并说明其工作原理.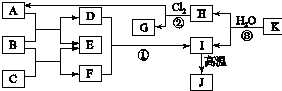 如图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源、燃料,J是一种耐高温材料且是两性氧化物,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出).
如图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源、燃料,J是一种耐高温材料且是两性氧化物,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出).