题目内容
1.短周期元素X、Y、Z、M的原子序数依次增大,原子X的L层电子数是K层的2倍,Y2+电子层结构与氖相同,Z原子的质子数为偶数,室温下M单质为淡黄色固体,下列有关说法正确的是( )| A. | X、Y、Z、M的原子半径依次减小 | |
| B. | Y与M组成化合物的熔点高于X与M组成的化合物 | |
| C. | X、Z、M的最低价气态氢化物的热稳定性依次增强 | |
| D. | X的单质与Y、Z的最高价氧化物均能发生置换反应 |
分析 短周期元素X、Y、Z、M 的原子序数依次增大,原子X的L层电子数是K层的2倍,则X最外层含有4个电子,为C元素;Y2+的电子层结构与氖相同,则Y为Mg;室温下M 的单质为淡黄色固体,则M为S元素;而Z的原子序数大于Mg而小于S,且质子数为偶数,则Z为Si元素,据此分析解答.
解答 解:短周期元素X、Y、Z、M 的原子序数依次增大,原子X的L层电子数是K层的2倍,则X最外层含有4个电子,为C元素;Y2+的电子层结构与氖相同,则Y为Mg;室温下M 的单质为淡黄色固体,则M为S元素;而Z的原子序数大于Mg而小于S,且质子数为偶数,则Z为Si元素,
A.Y、Z、M都含有3个电子层,原子序数越大原子半径越小,则原子半径Y>Z>M,故A错误;
B.Y与M组成化合物为MgS,X与M组成的化合物为CS2,MgS形成晶体为离子晶体,二硫化碳形成的晶体为分子晶体,则MgS晶体的熔沸点较高,故B正确;
C.非金属性越强,对应氢化物的稳定性越强,非金属性S>C>Si,则最低价气态氢化物的热稳定性:M>X>Z,故C错误;
D.X的单质为C,Y、Z的最高价氧化物的最高价氧化物分别为MgO、SiO2,Mg的金属性较强,C不能与MgO发生反应,故D错误;
故选B.
点评 本题考查了原子结构与元素周期律的关系,题目难度中等,正确推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
14.如图所示电化学装置(电极都是惰性电极)的判断合理的是( )
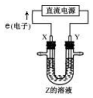

| A. | 若 Z 为饱和食盐水,则 X 是阴极 | |
| B. | 若 Z 为饱和食盐水,则碱在 X 附近生成 | |
| C. | 若 Z 为氯化铜溶液,Y 附近能得到氯气 | |
| D. | 若 Z 为氯化铜溶液,X 附近发生氧化反应 |
14.现有a、b、c、d四种短周期主族元素其原子序数依次增大,a与b位于不同周期,b与c位于相邻主族,c与d同主族.c的原子半径是同周期元素原子中最小的,下列说法不正确的是( )
| A. | 简单离子的半径:b>c | B. | 化合物ac是弱电解质 | ||
| C. | 化合物db2可作漂白剂 | D. | 化合物ad的水溶液能蚀刻玻璃. |
10. 塑化剂是一种对人体有害的物质,增塑剂DCHP可由邻苯二甲酸酐与环己醇反应制得.下列说法正确的是( )
塑化剂是一种对人体有害的物质,增塑剂DCHP可由邻苯二甲酸酐与环己醇反应制得.下列说法正确的是( )
 塑化剂是一种对人体有害的物质,增塑剂DCHP可由邻苯二甲酸酐与环己醇反应制得.下列说法正确的是( )
塑化剂是一种对人体有害的物质,增塑剂DCHP可由邻苯二甲酸酐与环己醇反应制得.下列说法正确的是( )| A. | 环己醇能与溴水发生取代反应 | |
| B. | 1molDCHP可与2molNaOH完全反应 | |
| C. | DCHP与邻苯二甲酸酐均含有酯基,所以它们互为同系物 | |
| D. | DCHP易溶于水 |
17.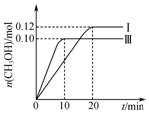 一定温度下,在三个容积均为2.0L的恒容密闭容器中发生反应:CO(g)+2H2(g)?CH3OH(g),各容器中起始物质的物质的量与反应温度见表,反应过程中容器Ⅰ、Ⅲ中CH3OH的物质的量随时间变化关系如图所示:下列说法正确的是( )
一定温度下,在三个容积均为2.0L的恒容密闭容器中发生反应:CO(g)+2H2(g)?CH3OH(g),各容器中起始物质的物质的量与反应温度见表,反应过程中容器Ⅰ、Ⅲ中CH3OH的物质的量随时间变化关系如图所示:下列说法正确的是( )
 一定温度下,在三个容积均为2.0L的恒容密闭容器中发生反应:CO(g)+2H2(g)?CH3OH(g),各容器中起始物质的物质的量与反应温度见表,反应过程中容器Ⅰ、Ⅲ中CH3OH的物质的量随时间变化关系如图所示:下列说法正确的是( )
一定温度下,在三个容积均为2.0L的恒容密闭容器中发生反应:CO(g)+2H2(g)?CH3OH(g),各容器中起始物质的物质的量与反应温度见表,反应过程中容器Ⅰ、Ⅲ中CH3OH的物质的量随时间变化关系如图所示:下列说法正确的是( )| 容器 | 温度/℃ | 起始物质的量/mol | ||
| CO(g) | H2(g) | CH3OH(g) | ||
| Ⅰ | T1 | 0.2 | 0.4 | 0 |
| Ⅱ | T1 | 0 | 0 | 0.4 |
| Ⅲ | T2 | 0.2 | 0.4 | 0 |
| A. | 在前20 min内,容器Ⅰ中反应的平均速率为v(H2)=0.012 mol•L-1•min-1 | |
| B. | 达到平衡后,容器Ⅰ中再充入0.20 mol CO和0.20 mol CH3OH,此时v(正)>v(逆) | |
| C. | 达到平衡时,容器Ⅱ中的压强一定大于容器Ⅰ中的压强的两倍 | |
| D. | 将容器Ⅲ改为绝热容器,实验起始温度为T2,达到平衡时,CO的转化率小于50% |
6.用NA表示阿伏加德罗常数的值,下列叙述中不正确的是( )
| A. | 22.4L氯气与足量镁粉充分反应后,转移的电子数为2NA | |
| B. | 常温下,1L0.5mo1•L-1 FeCl3溶液中含有的Fe3+数目一定小于0.5NA | |
| C. | 12g石墨中含有C-C共价键数为1.5NA | |
| D. | 28g由乙烯和环丁烷(C4H8)组成的混合气体中含有的碳原子数为2NA |
13.化学与生活密切相关,下列有关说法正确的是( )
| A. | 聚氯乙烯塑料制品可用于食品的包装 | |
| B. | 植物油和矿物油都不溶于水,但可用NaOH溶液区分 | |
| C. | “皮革奶”、“人造丝”灼烧时都有烧焦羽毛的气味 | |
| D. | 糖尿病人应少吃含糖类的食品,可常喝糯米八宝粥 |
10. 金属有机骨架材料(MOFs)为继碳纳米管后的又一种新型多孔材料.如图所示有机物可用于合成该材料,下列有关该有机物的说法,不正确的是( )
金属有机骨架材料(MOFs)为继碳纳米管后的又一种新型多孔材料.如图所示有机物可用于合成该材料,下列有关该有机物的说法,不正确的是( )
 金属有机骨架材料(MOFs)为继碳纳米管后的又一种新型多孔材料.如图所示有机物可用于合成该材料,下列有关该有机物的说法,不正确的是( )
金属有机骨架材料(MOFs)为继碳纳米管后的又一种新型多孔材料.如图所示有机物可用于合成该材料,下列有关该有机物的说法,不正确的是( )| A. | 该有机物能发生加成反应 | |
| B. | 7.8g该有机物含0.2 mol N | |
| C. | 该有机物的一氯代物只有2种 | |
| D. | 分子中的所有原子可能处于同一平面 |