题目内容
16.若NA代表阿伏加德罗常数,则下列说法中正确的是( )| A. | 78gNa2O2固体与62gNa2O固体中阴、阳离子总数均为3NA | |
| B. | 在2H2O+2Na2O2=4NaOH+O2↑的反应中,当产生标况下5.6LO2时,转移的电子数为NA | |
| C. | 1mol SiO2分子中含NA个Si原子和2NA个氧原子 | |
| D. | 54g铝与足量的稀硝酸反应产生的氢气分子数为3NA |
分析 A.过氧化钠中阴离子为过氧根离子;
B.气体状况未知;
C.二氧化硅为原子晶体;
D.硝酸与任何金属反应都不产生氢气.
解答 解:A.78gNa2O2固体物质的量为$\frac{78g}{78g/mol}$=1mol,含有2mol钠离子、1mol过氧根离子,阴、阳离子总数为3NA;62gNa2O固体物质的量$\frac{62g}{62g/mol}$=1mol,含有2mol钠离子,1mol氧离子,阴、阳离子总数为3NA,故A正确;
B.气体状况未知,无法计算氧气的物质的量和转移电子数目,故B错误;
C.二氧化硅为原子晶体,不含分子,故C错误;
D.硝酸与任何金属反应都不产生氢气,故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数的应用,掌握阿伏伽德罗常数与物质的量、摩尔质量等之间的转化关系,明确气体摩尔体积使用条件和对象是解题关键,题目难度不大.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
6. 2016年12月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因.
2016年12月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因.
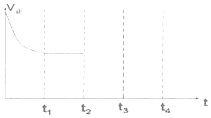
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ N2(g)+2CO2(g)△H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1时刻达到平衡状态.
①能判断该反应达到平衡状态的标志是CD.
A.在单位时间内生成1molCO2的同时消耗了1molCO B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变 D.混合气体的压强不再变化
②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件.请在图中补充画出从t2到t4时刻正反应速率随时间的变化曲线:
③若要同时提高该反应的速率和NO的转化率,采取的措施有增大压强或向容器中充入CO气体.(任写1个)
(2)改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气,其反应为C(s)+H2O(g)?CO(g)+H2(g)△HZZ=+131.3kJ•mol-1
①该反应在高温下能自发进行(填“高温”、“低温”或“任意温度”).
②煤气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为CO32-+H2S=HCO3-+HS-.(已知:H2S:Ka1=9.1×10-8;Ka2=1.1×10-12.H2CO3:Ka1=4.3×10-7;Ka2=5.6×10-11.)
(3)已知反应:CO(g)+H2O(g)?CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据
①实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是a<b.
②若在900℃时,另做一组实验,在此容器中加入10molCO、5molH2O、2molCO2、5molH2,则此时V正<V逆(填“<”,“>”,“=”).
 2016年12月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因.
2016年12月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因.(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ N2(g)+2CO2(g)△H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1时刻达到平衡状态.
①能判断该反应达到平衡状态的标志是CD.
A.在单位时间内生成1molCO2的同时消耗了1molCO B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变 D.混合气体的压强不再变化
②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件.请在图中补充画出从t2到t4时刻正反应速率随时间的变化曲线:
③若要同时提高该反应的速率和NO的转化率,采取的措施有增大压强或向容器中充入CO气体.(任写1个)
(2)改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气,其反应为C(s)+H2O(g)?CO(g)+H2(g)△HZZ=+131.3kJ•mol-1
①该反应在高温下能自发进行(填“高温”、“低温”或“任意温度”).
②煤气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为CO32-+H2S=HCO3-+HS-.(已知:H2S:Ka1=9.1×10-8;Ka2=1.1×10-12.H2CO3:Ka1=4.3×10-7;Ka2=5.6×10-11.)
(3)已知反应:CO(g)+H2O(g)?CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②若在900℃时,另做一组实验,在此容器中加入10molCO、5molH2O、2molCO2、5molH2,则此时V正<V逆(填“<”,“>”,“=”).
7.设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
| A. | 1 mol甲基(-CH3)所含电子数为9NA | |
| B. | 标准状况下,22.4 L己烷中含氢原子数目为14NA | |
| C. | 标准状况下,B2H6和C2H4的混合气体22.4 L,所含的电子数约为16NA | |
| D. | 26 g C2H2和苯蒸气的混合气体中所含的C原子数为2NA |
4.一定条件下恒容容器内反应2AB(g)?A2(g)+B2(g)达到平衡状态的标志是( )
| A. | 单位时间内生成nmol A2,同时生成2n mol AB | |
| B. | 反应混合气体总压强不随时间而变化 | |
| C. | 反应混合气体密度不随时间而变化 | |
| D. | 容器中各组分的质量分数不随时间而变化 |
1.下列实验装置图所示的实验操作,不能达到相应的实验目的是( )
| A. |  闻气体的气味 | B. | 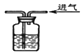 用浓硫酸干燥CO2 | ||
| C. | 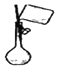 向容量瓶中转移液体 | D. | 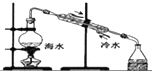 用海水提取淡水 |
8. 某研究小组设计如图所示实验装置(夹持及控温装置省略),用Cu(NO3)2•3H2O晶体和SOCl2制备少量无水Cu(NO3)2.已知SOC12熔点-l05℃、沸点76℃、遇水剧烈水解生成两种酸性气体..
某研究小组设计如图所示实验装置(夹持及控温装置省略),用Cu(NO3)2•3H2O晶体和SOCl2制备少量无水Cu(NO3)2.已知SOC12熔点-l05℃、沸点76℃、遇水剧烈水解生成两种酸性气体..
(1)①仪器c的名称是球形干燥管.
②向三颈烧瓶中缓慢滴加SOC12时,需打开活塞b(选填“a”、“b”或“a 和 b”).
(2)装置A中Cu(NO3)2•3H2O和SOC12发生反应的化学方程式是Cu(NO3)2•3H2O+3SOC12$\frac{\underline{\;\;△\;\;}}{\;}$Cu(NO3)2+3SO2↑+6HCI↑.
(3)装置B的作用是吸收SO2和HCl,防止倒吸.
(4)实验室以含铁的铜屑为原料制备Cu(NO3)2•3H2O的实验方案如下:
铜屑(含铁)$→_{步骤Ⅰ}^{稍过量稀HNO_{3}}$溶液Ⅰ→…→Cu(NO3)2•3HO2晶体
己知几种离子生成氢氧化物沉淀的pH如表
①步骤I中所用稀HNO3稍过量的目的是将铁元素全部转化为Fe3+.
②请补充完整由溶液I制备Cu(NO3)2•3H2O晶体的实验方案:向溶液I中加入Cu(OH)2或Cu2(OH)2CO3至溶液3.2<pH<4.2,过滤,将所得滤液蒸发浓缩、冷却结晶、过滤,冰水洗涤得到Cu(NO3)2•3H2O晶体.
 某研究小组设计如图所示实验装置(夹持及控温装置省略),用Cu(NO3)2•3H2O晶体和SOCl2制备少量无水Cu(NO3)2.已知SOC12熔点-l05℃、沸点76℃、遇水剧烈水解生成两种酸性气体..
某研究小组设计如图所示实验装置(夹持及控温装置省略),用Cu(NO3)2•3H2O晶体和SOCl2制备少量无水Cu(NO3)2.已知SOC12熔点-l05℃、沸点76℃、遇水剧烈水解生成两种酸性气体..(1)①仪器c的名称是球形干燥管.
②向三颈烧瓶中缓慢滴加SOC12时,需打开活塞b(选填“a”、“b”或“a 和 b”).
(2)装置A中Cu(NO3)2•3H2O和SOC12发生反应的化学方程式是Cu(NO3)2•3H2O+3SOC12$\frac{\underline{\;\;△\;\;}}{\;}$Cu(NO3)2+3SO2↑+6HCI↑.
(3)装置B的作用是吸收SO2和HCl,防止倒吸.
(4)实验室以含铁的铜屑为原料制备Cu(NO3)2•3H2O的实验方案如下:
铜屑(含铁)$→_{步骤Ⅰ}^{稍过量稀HNO_{3}}$溶液Ⅰ→…→Cu(NO3)2•3HO2晶体
己知几种离子生成氢氧化物沉淀的pH如表
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+• | 4.2 | 6.7 |
②请补充完整由溶液I制备Cu(NO3)2•3H2O晶体的实验方案:向溶液I中加入Cu(OH)2或Cu2(OH)2CO3至溶液3.2<pH<4.2,过滤,将所得滤液蒸发浓缩、冷却结晶、过滤,冰水洗涤得到Cu(NO3)2•3H2O晶体.
5.下列离子或分子在溶液中能大量共存且满足相应要求的是( )
| 选项 | 离子或分子 | 要求 |
| A | K+、SO42-、Cl-、HS- | c(K+)<c(SO42-) |
| B | Na+、Al3+、Cl-、SO42- | 滴加氨水立即有沉淀产生 |
| C | NH4+、Ba2+、NO3-、CH3COOH | 滴加NaOH溶液立即有气泡产生 |
| D | Fe3+ Na+、NO3-、ClO- | 溶液pH=l |
| A. | A | B. | B | C. | C | D. | D |
6.在50mL 0.1mol/L Na2S 溶液中逐滴加入50mL 0.1mol/L KHSO4溶液,所得溶液中粒子浓度关系正确的是( )
| A. | c(SO42-)=c(HS-)=c(K+)>c(OH-)=c(H+) | |
| B. | c(Na+)>c(K+)>c(S2-)>c(H+)>c(OH-) | |
| C. | c(Na+)=c(S2-)+c(HS-)+c(H2S)+c(SO42-) | |
| D. | c(K+)+c(Na+)+c(H+)=c(SO42-)+c(S2-)+c(HS-)+c(OH-) |