题目内容
19.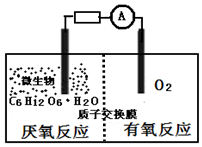 微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )| A. | 负极反应中有CO2生成 | |
| B. | 微生物促进了反应中电子的转移 | |
| C. | 质子通过交换膜从正极区移向负极区 | |
| D. | 电池总反应为C6H12O6+6O2═6CO2+6H2O |
分析 A.根据图知,负极上C6H12O6失电子,正极上O2得电子和H+反应生成水,负极的电极反应式为C6H12O6+6H2O-24e-=6CO2+24H+,正极的电极反应式为O2+4e-+4H+═2H2O;
B.葡萄糖在微生物的作用下将化学能转化为电能,形成原电池;
C.原电池中,阳离子向正极移动,所以质子通过交换膜从负极区移向正极区;
D.燃料电池反应式和燃料燃烧方程式相同.
解答 解:A.根据图知,负极上C6H12O6失电子,正极上O2得电子和H+反应生成水,负极的电极反应式为C6H12O6+6H2O-24e-=6CO2+24H+,正极的电极反应式为O2+4e-+4H+═2H2O,因此CO2在负极产生,故A正确;
B.葡萄糖在微生物的作用下将化学能转化为电能,形成原电池,有电流产生,所以微生物促进了反应中电子的转移,故B正确;
C.通过原电池的电极反应可知,负极区产生了H+,根据原电池中阳离子向正极移动,可知质子(H+)通过交换膜从负极区移向正极区,故C错误;
D.该反应属于燃料电池,燃料电池的电池反应式和燃烧反应式相同,则电池反应式为C6H12O6+6O2=6CO2+6H2O,故D正确;
故选C.
点评 本题考查化学电源新型电池,为高频考点,正确判断电解质溶液酸碱性是解本题关键,所有原电池中都是负极上失电子发生氧化反应、正极上得电子发生还原反应,难点是电极反应式的书写.

练习册系列答案
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案
相关题目
9.常温下,下列说法错误的是( )
| A. | pH=6的NaHSO4溶液:c(Na+)+c(H+)=2c(SO42-)+c(OH-) | |
| B. | 0.1 mol/L NaHCO3溶液加水稀释后,c(H+)与c(OH-)的乘积不变 | |
| C. | pH相同的①CH3COONa、②NaClO两种溶液的c(Na+):①<② | |
| D. | 反应2Mg(s)+CO2(g)═C(s)+2MgO(s)能自发进行,则该反应的△H<0 |
10.下列有关水在人体中的作用的说法不正确的是( )
| A. | 水能调节人体体温 | B. | 水在人体内分解会放出热量 | ||
| C. | 水是人体内进行生化反应的介质 | D. | 水在人体内是一种良好的溶剂 |
7.设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
| A. | 1 mol甲基(-CH3)所含电子数为9NA | |
| B. | 标准状况下,22.4 L己烷中含氢原子数目为14NA | |
| C. | 标准状况下,B2H6和C2H4的混合气体22.4 L,所含的电子数约为16NA | |
| D. | 26 g C2H2和苯蒸气的混合气体中所含的C原子数为2NA |
14.下列关于CO2的叙述正确的是( )
| A. | CO2的摩尔质量是44g | |
| B. | 1mol CO2的体积约为22.4L | |
| C. | 1mol CO2的质量是44g/mol | |
| D. | 1mol CO2中所含分子数约为6.02×1023个 |
4.一定条件下恒容容器内反应2AB(g)?A2(g)+B2(g)达到平衡状态的标志是( )
| A. | 单位时间内生成nmol A2,同时生成2n mol AB | |
| B. | 反应混合气体总压强不随时间而变化 | |
| C. | 反应混合气体密度不随时间而变化 | |
| D. | 容器中各组分的质量分数不随时间而变化 |
8. 某研究小组设计如图所示实验装置(夹持及控温装置省略),用Cu(NO3)2•3H2O晶体和SOCl2制备少量无水Cu(NO3)2.已知SOC12熔点-l05℃、沸点76℃、遇水剧烈水解生成两种酸性气体..
某研究小组设计如图所示实验装置(夹持及控温装置省略),用Cu(NO3)2•3H2O晶体和SOCl2制备少量无水Cu(NO3)2.已知SOC12熔点-l05℃、沸点76℃、遇水剧烈水解生成两种酸性气体..
(1)①仪器c的名称是球形干燥管.
②向三颈烧瓶中缓慢滴加SOC12时,需打开活塞b(选填“a”、“b”或“a 和 b”).
(2)装置A中Cu(NO3)2•3H2O和SOC12发生反应的化学方程式是Cu(NO3)2•3H2O+3SOC12$\frac{\underline{\;\;△\;\;}}{\;}$Cu(NO3)2+3SO2↑+6HCI↑.
(3)装置B的作用是吸收SO2和HCl,防止倒吸.
(4)实验室以含铁的铜屑为原料制备Cu(NO3)2•3H2O的实验方案如下:
铜屑(含铁)$→_{步骤Ⅰ}^{稍过量稀HNO_{3}}$溶液Ⅰ→…→Cu(NO3)2•3HO2晶体
己知几种离子生成氢氧化物沉淀的pH如表
①步骤I中所用稀HNO3稍过量的目的是将铁元素全部转化为Fe3+.
②请补充完整由溶液I制备Cu(NO3)2•3H2O晶体的实验方案:向溶液I中加入Cu(OH)2或Cu2(OH)2CO3至溶液3.2<pH<4.2,过滤,将所得滤液蒸发浓缩、冷却结晶、过滤,冰水洗涤得到Cu(NO3)2•3H2O晶体.
 某研究小组设计如图所示实验装置(夹持及控温装置省略),用Cu(NO3)2•3H2O晶体和SOCl2制备少量无水Cu(NO3)2.已知SOC12熔点-l05℃、沸点76℃、遇水剧烈水解生成两种酸性气体..
某研究小组设计如图所示实验装置(夹持及控温装置省略),用Cu(NO3)2•3H2O晶体和SOCl2制备少量无水Cu(NO3)2.已知SOC12熔点-l05℃、沸点76℃、遇水剧烈水解生成两种酸性气体..(1)①仪器c的名称是球形干燥管.
②向三颈烧瓶中缓慢滴加SOC12时,需打开活塞b(选填“a”、“b”或“a 和 b”).
(2)装置A中Cu(NO3)2•3H2O和SOC12发生反应的化学方程式是Cu(NO3)2•3H2O+3SOC12$\frac{\underline{\;\;△\;\;}}{\;}$Cu(NO3)2+3SO2↑+6HCI↑.
(3)装置B的作用是吸收SO2和HCl,防止倒吸.
(4)实验室以含铁的铜屑为原料制备Cu(NO3)2•3H2O的实验方案如下:
铜屑(含铁)$→_{步骤Ⅰ}^{稍过量稀HNO_{3}}$溶液Ⅰ→…→Cu(NO3)2•3HO2晶体
己知几种离子生成氢氧化物沉淀的pH如表
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+• | 4.2 | 6.7 |
②请补充完整由溶液I制备Cu(NO3)2•3H2O晶体的实验方案:向溶液I中加入Cu(OH)2或Cu2(OH)2CO3至溶液3.2<pH<4.2,过滤,将所得滤液蒸发浓缩、冷却结晶、过滤,冰水洗涤得到Cu(NO3)2•3H2O晶体.
9.一定温度下,水存在H2O?H++OH-△H=Q(Q>0)的平衡,下列叙述一定正确的是( )
| A. | 向水中滴入少量稀盐酸,平衡逆向移动,Kw减小 | |
| B. | 将水加热,Kw增大,pH减小 | |
| C. | 向水中加入少量固体CH3COONa固体,平衡逆向移动,c(H+)降低 | |
| D. | 向水中加入少量固体硫酸钠,c(H+)和Kw均不变 |