题目内容
下列说法正确的是( )
| A、1mol氧气中含有1.204×1024个氧原子,通常情况下占有体积约为22.4L |
| B、1mol臭氧和1.5mol氧气含有相同的氧原子数 |
| C、等体积、浓度均为1mol/L的磷酸和盐酸,电离出的氢离子数之比为3:1 |
| D、欲配制1.00L1.00mol.L-1的NaCl溶液,可将58.5gNaCl溶于1.00L水中 |
考点:阿伏加德罗常数,气体摩尔体积
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.通常状况下,Vm≠22.4L/mol;
B.依据臭氧、氧气的分子式计算氧原子数;
C.磷酸为弱电解质,只能部分电离,不能完全电离出氢离子;
D.58.5gNaCl溶于1.00L水中,得到溶液的体积大于1L.
B.依据臭氧、氧气的分子式计算氧原子数;
C.磷酸为弱电解质,只能部分电离,不能完全电离出氢离子;
D.58.5gNaCl溶于1.00L水中,得到溶液的体积大于1L.
解答:
解:A.通常状况下,Vm≠22.4L/mol,所以1mol气体的体积不等于22.4L,故A错误;
B.1mol臭氧含有相同的氧原子数3mol,1.5mol氧气含有相同的氧原子数3mol,1mol臭氧和1.5mol氧气含有相同的氧原子数,故B正确;
C.磷酸为弱电解质,只能部分电离,氯化氢为强电解质,能够完全电离,所以相同物质的量的磷酸和盐酸电离出的氢离子小于3:1,故C错误;
D.58.5gNaCl的物质的量为1mol,溶于1.00L水中,得到溶液的体积大于1L,得到的溶液的物质的量浓度小于1.00mol.L-1,故D错误;
故选:B.
B.1mol臭氧含有相同的氧原子数3mol,1.5mol氧气含有相同的氧原子数3mol,1mol臭氧和1.5mol氧气含有相同的氧原子数,故B正确;
C.磷酸为弱电解质,只能部分电离,氯化氢为强电解质,能够完全电离,所以相同物质的量的磷酸和盐酸电离出的氢离子小于3:1,故C错误;
D.58.5gNaCl的物质的量为1mol,溶于1.00L水中,得到溶液的体积大于1L,得到的溶液的物质的量浓度小于1.00mol.L-1,故D错误;
故选:B.
点评:本题考查了阿伏伽德罗常数,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,是解题关键,注意气体摩尔体积适用的条件,题目难度不大.

练习册系列答案
相关题目
下列关于杂化轨道的叙述中,不正确的是( )
| A、杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对 |
| B、分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构 |
| C、杂化前后的轨道数不变,但轨道的形状发生了改变 |
| D、sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180° |
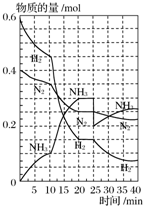 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,下列说法中正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,下列说法中正确的是( )| A、从反应开始到第一次平衡时,N2的平均反应速率为0.005 mol?L-1?min-1 |
| B、平衡在10 min至20 min的变化,可能是因为增大了容器体积 |
| C、25 min时,分离出了0.1 mol NH3 |
| D、在25 min后平衡向正反应方向移动,新平衡中NH3的体积分数比原平衡的小 |
下列溶液中,Na+数目最多的是( )
| A、1 mol?L-1 Na2SO4溶液100mL |
| B、0.9 mol?L-1Na3PO4溶液100mL |
| C、2.5 mol?L-1NaOH 溶液100mL |
| D、1 mol?L-1 NaHCO3溶液100mL |
1 1 |
2 1 |
3 1 |
| A、氢的五种同位素 |
| B、五种氢元素 |
| C、氢的五种原子 |
| D、氢元素的五种不同微粒 |
下列说法正确的是( )
| A、电解质在水中一定能导电 |
| B、纯水的导电性很差,所以水不是电解质 |
| C、溶液导电性的强弱取决于溶液中离子浓度及所带电荷的多少 |
| D、NaCl溶液在电流作用下电离成Na+与Cl- |