题目内容
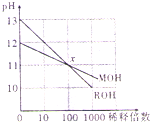 常温下,两种一元碱MOH和ROH的溶液分别加水稀释时,pH变化如图所示.下列有关说法正确的是( )
常温下,两种一元碱MOH和ROH的溶液分别加水稀释时,pH变化如图所示.下列有关说法正确的是( )| A、RCl溶液pH<7 |
| B、稀释前,c(ROH)=10c(MOH) |
| C、在x点,c(M+)=c(R+) |
| D、等体积的pH=12的MOH溶液和pH=2的盐酸混合,c(M+)=c(Cl-) |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:由图可知,ROH的pH=13时稀释100倍,pH变为11,则ROH为强碱;而MOH的pH=12时稀释100倍,pH变为11,则说明MOH为弱碱,以此来解答.
解答:
解:A.由图可知,ROH的pH=13时稀释100倍,pH变为11,则ROH为强碱,则RCl为强酸强碱盐,所以RCl溶液pH=7,故A错误;
B.ROH为强碱,稀释前浓度为0.1mol/L,MOH的pH=12时稀释100倍,pH变为11,则说明MOH为弱碱,稀释前MOH的浓度大于0.01mol/L,则稀释前c(ROH)<10c(MOH),故B错误;
C.在X点,pH相同,则c(OH-)相同,由电荷守恒可知,c(M+)=c(R+),故C正确;
D.MOH为弱碱,pH=12的MOH溶液浓度为大于0.01mol/L,pH=2的盐酸的浓度等于0.01mol/L,所以二者等体积混合时MOH过量,则c(M+)>c(Cl-),故D错误;
故选C.
B.ROH为强碱,稀释前浓度为0.1mol/L,MOH的pH=12时稀释100倍,pH变为11,则说明MOH为弱碱,稀释前MOH的浓度大于0.01mol/L,则稀释前c(ROH)<10c(MOH),故B错误;
C.在X点,pH相同,则c(OH-)相同,由电荷守恒可知,c(M+)=c(R+),故C正确;
D.MOH为弱碱,pH=12的MOH溶液浓度为大于0.01mol/L,pH=2的盐酸的浓度等于0.01mol/L,所以二者等体积混合时MOH过量,则c(M+)>c(Cl-),故D错误;
故选C.
点评:本题考查强碱、弱碱稀释及图象,明确图象中pH的变化是解答本题的关键,并注意利用pH与浓度的关系来解答,题目难度中等.

练习册系列答案
相关题目
某实验室的尾气中含有较多的氯气,下列试剂用来吸收氯气最适合的是( )
| A、澄清的石灰水 |
| B、饱和食盐水 |
| C、自来水 |
| D、NaOH溶液 |
将1.12g铁粉加到25mL 2mol/L的氯化铁溶液中,完全反应后,其结果是( )
| A、铁有剩余,溶液呈浅绿色,c(Cl-)基本不变 |
| B、往溶液中滴加无色KSCN溶液,显红色 |
| C、溶液中n(Fe2+)与n(Fe3+)之比为6:1 |
| D、氧化产物与还原产物的物质的量之比为2:5 |
现有常温下的四份溶液:①PH=2的CH3COOH ②PH=2的HCI ③0.01mol/L的氨水 ④0.01mol/L的NaOH溶液.将四份溶液稀释相同倍数后,溶液的PH由大到小的顺序是( )
| A、①②③④ | B、④③②① |
| C、③④②① | D、④③①② |
下面有关合金说法正确的是( )
| A、现代使用最广泛的合金是铝合金 |
| B、我国使用最早的合金是铁合金 |
| C、合金的熔点比各组分单质大 |
| D、合金的硬度比各组分单质大 |
下列事实能用同一原理解释的是( )
| A、Na2O2和活性炭均能使品红溶液褪色 |
| B、对碘晶体和碳酸氢铵晶体加热,晶体均会逐渐消失 |
| C、SO2能使滴加酚酞的NaOH溶液和酸性KMnO4溶液的红色都褪去 |
| D、实验室配制FeC13溶液和SnC12溶液时,先将固体FeC13和SnCl2分别溶解在浓盐酸中,再加蒸馏水稀释 |
下列说法正确的是( )
| A、根据类推思想,氯化铝溶液蒸干后灼烧,最后得到氧化铝,则硫酸铝也一样 |
| B、HCl和NaOH反应的中和热为△H,则H2SO4和Ca(OH)2反应的中和热为2△H |
| C、一定条件下的可逆反应2NO2?2NO+O2,若混合气体的颜色不变,则该反应已达平衡状态 |
| D、在NH4Cl水溶液中,为使c(NH4+)=c(Cl-),理论上可通入氨气或氯化氢气体实现 |
NA代表阿伏加德罗常数的数值,下列叙述正确的是( )
| A、在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,转移4NA个电子 |
| B、1.0L 1.0mol/L NaAlO2水溶液中含有的氧原子数为2NA |
| C、标准状况下分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g |
| D、假设1mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶粒微粒数为NA |
下列分子中存在π键的是( )
| A、H2O |
| B、CH4 |
| C、NH3 |
| D、CO2 |