题目内容
现有常温下的四份溶液:①PH=2的CH3COOH ②PH=2的HCI ③0.01mol/L的氨水 ④0.01mol/L的NaOH溶液.将四份溶液稀释相同倍数后,溶液的PH由大到小的顺序是( )
| A、①②③④ | B、④③②① |
| C、③④②① | D、④③①② |
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:相同的pH的醋酸和氯化氢,醋酸的浓度大于氯化氢,稀释相同的倍数后,醋酸中氢离子浓度较大,溶液的pH需要氯化氢;氨水为弱碱,氢氧化钠为强碱,浓度相同的氨水和氢氧化钠溶液稀释相同倍数后,二者浓度仍然相同,由于氢氧化钠是强电解质,则氢氧化钠溶液中氢氧根离子浓度大于氨水,氢氧化钠溶液的pH大于氨水的pH.
解答:
解:醋酸为弱电解质,①pH=2的醋酸中,醋酸的浓度大于0.01mol/L;②pH=2的氯化氢溶液中,氯化氢的浓度为0.01mol/L,稀释相同的倍数后,醋酸的电离程度增大,醋酸电离出的氢离子的物质的量增大,稀释后的醋酸溶液中氢离子浓度大于氯化氢溶液,所以溶液的pH大小为:①<②<7;
③0.01mol/L的氨水和④0.01mol/L的NaOH溶液稀释相同倍数后,氨水和氢氧化钠的浓度相同,由于氢氧化钠为强电解质,所以氢氧化钠溶液中氢氧根离子离子浓度大于氨水的,所以稀释后溶液的pH大小为:④>③>7,
所以将四份溶液稀释相同倍数后,溶液的PH由大到小的顺序是:④>③>②>①,
故选B.
③0.01mol/L的氨水和④0.01mol/L的NaOH溶液稀释相同倍数后,氨水和氢氧化钠的浓度相同,由于氢氧化钠为强电解质,所以氢氧化钠溶液中氢氧根离子离子浓度大于氨水的,所以稀释后溶液的pH大小为:④>③>7,
所以将四份溶液稀释相同倍数后,溶液的PH由大到小的顺序是:④>③>②>①,
故选B.
点评:本题考查了溶液pH的计算、弱电解质的电离及其影响,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,明确弱电解质电离及其影响因素,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
下列各面组物质的溶液逐滴互滴,前一种溶液逐滴滴入后一种溶液中,与后一种溶液逐滴滴入前一种溶液中产生的现象相同的是( )
①NaHCO3和HCl ②HNO3和Na[Al(OH)4]③AlCl3 和NaOH ④Ca(HCO3)2和Ca(OH)2
⑤Na2CO3和HCl.
①NaHCO3和HCl ②HNO3和Na[Al(OH)4]③AlCl3 和NaOH ④Ca(HCO3)2和Ca(OH)2
⑤Na2CO3和HCl.
| A、①⑤ | B、②④ | C、②⑤ | D、①④ |
能确认化学平衡一定发生移动的是( )
| A、化学反应速率发生了改变 |
| B、可逆反应达到平衡后,使用催化剂 |
| C、有气态物质参加的可逆反应达到平衡后,改变压强 |
| D、由于某一条件的改变,使平衡混合物中各组分的浓度发生了不同程度的改变 |
下列有关说法中正确的是( )
| A、0.5mol Cl-离子的摩尔质量为17.75g?mol-1 |
| B、漂白粉在空气中久置变质发生了氧化还原反应 |
| C、向饱和烧碱溶液中加入一定量的Na2O2,充分反应后,使之恢复至原来温度时,溶液中Na+浓度增大,并有氧气放出 |
| D、相同状况下,等质量的12C18O和14N2气体,它们所含有的质子数相等 |
下列离子方程式正确的是( )
| A、Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- |
| B、Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O |
| C、明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-═2BaSO4↓+Al(OH)3↓ |
| D、双氧水加入稀硫酸和KI溶液:H2O2+2H++2I-═I2+2H2O |
下列离子或分子在溶液中能大量共存,加入Na2O2后仍能大量共存的一组是( )
| A、Fe2+、NH4+、SO42-、Cl- |
| B、Mg2+、Na+、ClO-、NO3- |
| C、Na+、Ca2+、Cl-、HCO3- |
| D、K+、Na+、Br-、SiO32- |
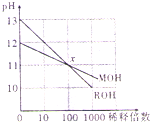 常温下,两种一元碱MOH和ROH的溶液分别加水稀释时,pH变化如图所示.下列有关说法正确的是( )
常温下,两种一元碱MOH和ROH的溶液分别加水稀释时,pH变化如图所示.下列有关说法正确的是( )| A、RCl溶液pH<7 |
| B、稀释前,c(ROH)=10c(MOH) |
| C、在x点,c(M+)=c(R+) |
| D、等体积的pH=12的MOH溶液和pH=2的盐酸混合,c(M+)=c(Cl-) |
下列各组液态混合物,能用分液漏斗进行分离的是( )
| A、CH3CH2OH和H2O |
| B、I2和CCl4 |
| C、H2O和植物油 |
| D、苯和甲苯 |
下列防止地下钢管锈蚀的措施中,不正确的是( )
| A、在钢管表面喷油漆 |
| B、使它与铜板相连 |
| C、使它与锌板相连 |
| D、使它与电源负极相连 |