题目内容
取1mol H2S完全燃烧生成液态水和气态二氧化硫,放出热量为Q1;不完全燃烧生成气态水和硫,放出热量为Q2;不完全燃烧生成液态水和硫,放出热量为Q3,则下列关系正确的是( )
| A、Q3>Q2>Q1 |
| B、Q1>Q2>Q3 |
| C、Q1>Q3>Q2 |
| D、Q2>Q1>Q3 |
考点:反应热的大小比较
专题:化学反应中的能量变化
分析:反应放出的热量与物质的聚集状态、反应物的用量有关,物质由液体转化为气体要吸热,反之放热,以此解答该题.
解答:
解:H2S完全燃烧比不完全燃烧放热多,所以Q1>Q2,Q1>Q3;气态液化成液态,需要进一步放热,所以Q2<Q3,故Q1>Q3>Q2,
故选:C.
故选:C.
点评:本题考查反应热大小的比较,难度不大,解题时注意物质的聚集状态、反应物的用量与反应热的大小的关系即可解答该题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列有关物质性质的说法错误的是( )
| A、热稳定性:HCl>HI |
| B、原子半径:Na>Mg |
| C、酸性:H2SO3>H2SO4 |
| D、结合质子能力:S2->Cl- |
已知:①H2O(g)═H2O(l)△H=-Q1 kJ?mol-1
②C2H5OH(g)═C2H5OH(l)△H=-Q2 kJ?mol-1
③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H=-Q3 kJ?mol-1
下列判断正确是( )
②C2H5OH(g)═C2H5OH(l)△H=-Q2 kJ?mol-1
③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H=-Q3 kJ?mol-1
下列判断正确是( )
| A、酒精的燃烧热△H=-Q3 kJ?mol-1 |
| B、由③可知1mol C2H5OH(g)的能量高于2mol CO2(g)和3mol H2O(g)的总能量 |
| C、H2O(g)→H2O(l)释放出了热量,所以该过程为放热反应 |
| D、23g液体酒精完全燃烧生成CO2(g)和H2O(l),释放出的热量为(0.5Q3-0.5Q2+1.5Q1)kJ |
 在容积为2L的恒容的密闭容器中,一定温度下,发生反应:aM(g)+bN(g)?cQ(g).气体M、N、Q的物质的量随时间的变化如图所示,则下列叙述正确的是( )
在容积为2L的恒容的密闭容器中,一定温度下,发生反应:aM(g)+bN(g)?cQ(g).气体M、N、Q的物质的量随时间的变化如图所示,则下列叙述正确的是( )A、该温度下此反应的平衡常数的值K=
| ||
| B、该反应前5min的平均速率:v(N)=0.002mol?L-1?min-1 | ||
| C、在5min时,再向体系中充入少量He,重新达到平衡前v(正)>v(逆) | ||
| D、若开始时向容器中充入2mol M和1mol N,达到平衡时,M的体积分数小于50% |
下列说法中正确的是( )
| A、凡是放热反应都是自发的,吸热反应都是非自发的 |
| B、非自发反应在任何条件下都不能实现 |
| C、熵增加且放热的反应一定是自发反应 |
| D、自发反应一定是熵增大,非自发反应一定是熵减小或不变 |
NA表示阿伏加德罗常数,下列说法正确的是( )
| A、2g H218O中含有NA个中子 |
| B、标准状况下,14g CO气体中含有的原子数为0.5NA |
| C、0.1mol NH3分子中含有0.9NA个电子 |
| D、2.24L CH4气体中所含原子数为0.5NA |
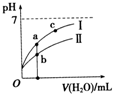 已知下表为250C时某些弱酸的电离平衡常数.如图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.依据所给信息,下列说法正确的是( )
已知下表为250C时某些弱酸的电离平衡常数.如图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.依据所给信息,下列说法正确的是( )| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
| A、相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:C(Na+)>C(ClO-)>C(CH3COO-)>C(OH-)>C(H+) |
| B、向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO32- |
| C、a、b、c三点所示溶液中水的电离程度c>a>b |
| D、图象中,I表示CH3COOH,Ⅱ表示HClO,且溶液导电性:c>b>a |
关于下列实验的叙述中正确的是( )
| A、溴乙烷在浓硫酸作用下加热可制得乙烯. |
| B、在制备乙酸乙酯实验中,长导管有冷凝蒸汽和导气的作用,饱和碳酸钠溶液液面上有油状并有香味液体生成 |
| C、实验室可用无水乙醇和过量的3mol/L硫酸的混合液制乙烯 |
| D、用电石和水可制得纯净的乙炔 |
以下措施都能使海洋钢质钻台增强抗腐蚀能力,其中属于“牺牲阳极的阴极保护法”的是( )
| A、对钢材“发蓝”(钝化) |
| B、选用铬铁合金 |
| C、外接电源负极 |
| D、连接锌块 |