题目内容
18.能证明KOH是离子化合物的事实是( )| A. | 常温下是固体 | B. | 易溶于水 | C. | 水溶液能导电 | D. | 熔融态能导电 |
分析 离子化合物在熔融状态下能电离生成阴阳离子而导电,共价化合物在熔融状态下以分子存在,据此分析解答.
解答 解:离子化合物在熔融状态下能电离生成阴阳离子而导电,共价化合物在熔融状态下以分子存在,所以在熔融状态下能导电的化合物是离子化合物,KOH在熔融状态下能导电,所以是离子化合物,与其状态、溶解性强弱、其水溶液是否导电都无关,故选D.
点评 本题考查离子化合物,为高频考点,明确离子化合物和共价化合物根本区别是解本题关键,注意:不能根据是否含有金属元素、其溶解性强弱判断化合物类型,题目难度不大.

练习册系列答案
相关题目
8.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 1.0mol•L-1NaClO溶液中:Fe2+、K+、I-、Cl- | |
| B. | 加入铝片能放出H2的溶液中:K+、Ba2+、Cl-、NH4+ | |
| C. | 由水电离出的c(OH-)=1×10-12mol•L-1溶液中:NH4+、HCO3-、Na+、Cl- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-14的溶液中:K+、Na+、I-、SiO32- |
9.某白色固体含有两种物质,为鉴别其成分进行如下实验:取少量样品加入适量水,固体全部溶解得到澄清溶液.往所得溶液中加入少量稀盐酸,产生白色沉淀.静置,取上层清液,加入少量Ba(OH)2溶液又产生白色沉淀.该白色固体的成分可能为( )
| A. | Ba(HCO3)2、Al(NO3)3 | B. | CaCl2、NaHCO3 | C. | Al2(SO4)3、NaOH | D. | Na2CO3、CuSO4 |
6.下列实验操作不能达到实验目的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 制备乙炔时,减缓乙炔的生成速率 | 用饱和食盐水替代水跟电石反应 |
| B | 证明NH4Cl溶液能促进Mg(OH)2固体的溶解 | 向两份等量的Mg(OH)2固体中分别加入等体积的蒸馏水和NH4Cl溶液 |
| C | 验证乙醇发生消去反应生成乙烯 | 将生成的气体直接通入含Br2的CCl4溶液中 |
| D | 证明Al2O3的熔点比Al高 | 把砂纸打磨过的铝箔在酒精灯上加热至熔化 |
| A. | A | B. | B | C. | C | D. | D |
13.化学在生活中应用广泛,下列物质性质与对应用途错误的是( )
| A. | 明矾易水解生成胶体,可用作净水剂 | |
| B. | 晶体硅熔点高硬度大,可用作芯片 | |
| C. | 氮气化学性质稳定,可用作粮食保护气 | |
| D. | NaClO具有强氧化性,可作织物漂白剂 |
3.X、Y、Z、W是原子序数依次增大的四种短周期主族元素.Y、Z同周期且相邻,X、W同主族且与Y处于不同周期,Y、Z原子的电子数总和与X、W原子的电子数总和之比为5:4.下列说法正确的是( )
| A. | 化合物WY3中只含有离子键 | |
| B. | Y的简单气态氢化物的沸点比Z的低 | |
| C. | 原子半径:r(W)>r(Z)>r(Y)>r(X) | |
| D. | 由X、Z组成的化合物与由Z、W组成的化合物只能发生化合反应 |
2.N2 (g) 与H2 (g) 在铁催化剂表面经历如右过程生成NH3 (g):下列说法正确的是( )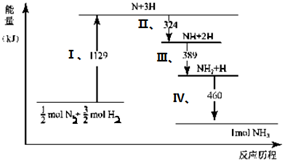

| A. | Ⅰ中1129 kJ为该反应过程的活化能 | |
| B. | N2(g)+3H2 (g)?2NH3 (g)△H=2(324+389+460-1129)kJ/mol | |
| C. | Ⅱ、Ⅲ、Ⅳ均为放热过程 | |
| D. | N2(g)+3H2 (g)?2NH3 (g)△H>0 |
20.下列说法错误的是( )
| A. | 乙酸的分子模型可表示为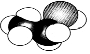 | |
| B. | 糖类、油脂、蛋自质都是高分子化合物 | |
| C. | 乙烯使溴的四氯化碳溶液褪色是因为发生了加成反应 | |
| D. | 炒菜时加酒和醋能使菜味香可口,原因是有酯类物质生成 |