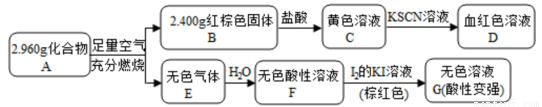
题目内容
14.在一定条件下,羧酸(分子式为C6H12O2)与1,3-丙二醇(HOCH2CH2CH2OH)发生酯化反应生成酯,这些酯在酸性条件下水解只生成两种有机物,满足以上条件的酯有( )| A. | 8种 | B. | 16种 | C. | 36种 | D. | 44种 |
分析 分子式为C6H12O2的羧酸,可以看做戊烷中H原子被-COOH,正戊烷被取代有3种,异戊烷被取代有4种,新戊烷被取代有1种,故该酸有8种,与1,3-丙二醇(HOCH2CH2CH2OH)发生酯化反应生成的酯在酸性条件下水解只生成两种有机物,说明形成酯的羧酸只有1种,可以是羧酸与1,3-丙二醇按1:1反应,也可能为2:1反应.
解答 解:分子式为C6H12O2的羧酸,可以看做戊烷中H原子被-COOH,正戊烷被取代有3种,异戊烷被取代有4种,新戊烷被取代有1种,故该酸有8种,与1,3-丙二醇(HOCH2CH2CH2OH)发生酯化反应生成的酯在酸性条件下水解只生成两种有机物,说明形成酯的羧酸只有1种,可以是羧酸与1,3-丙二醇按1:1反应形成一元酯,有8种,也可能为2:1反应生成二元酯,也有8种,故共有16种,
故选:B.
点评 本题考查有机物的结构与性质、同分异构体书写、有机物推断等,注意利用取代法确定羧酸的种类,侧重考查学生分析推理能力.

练习册系列答案
相关题目
2.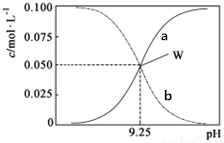 25℃时,将氨水与氯化铵溶液混合得到c(NH3•H2O)+c(NH4+)=0.1mol•L-1的混合溶液.溶液中c(NH3•H2O)、c(NH4+)与pH的关系如图所示.下列有关离子浓度关系叙述一定正确的是( )
25℃时,将氨水与氯化铵溶液混合得到c(NH3•H2O)+c(NH4+)=0.1mol•L-1的混合溶液.溶液中c(NH3•H2O)、c(NH4+)与pH的关系如图所示.下列有关离子浓度关系叙述一定正确的是( )
 25℃时,将氨水与氯化铵溶液混合得到c(NH3•H2O)+c(NH4+)=0.1mol•L-1的混合溶液.溶液中c(NH3•H2O)、c(NH4+)与pH的关系如图所示.下列有关离子浓度关系叙述一定正确的是( )
25℃时,将氨水与氯化铵溶液混合得到c(NH3•H2O)+c(NH4+)=0.1mol•L-1的混合溶液.溶液中c(NH3•H2O)、c(NH4+)与pH的关系如图所示.下列有关离子浓度关系叙述一定正确的是( )| A. | 曲线a代表c(NH3•H2O),曲线b代表(NH4+) | |
| B. | 25℃时,NH3•H2O的电离平衡常数Kb=10-4.75 | |
| C. | pH=10.5溶液中c(Cl-)+c(OH-)+c(NH3•H2O)<0.1 mol•L-1 | |
| D. | pH=9.5溶液中c(NH3•H2O)>c(NH4+)>c(OH-)>c(H+) |
9.下列各组物质中,总质量一定时,不论以何种比例混合,完全燃烧生成水的质量为一常量,且与CO2的量的比值一定的一组物质是( )
| A. | 甲烷和乙烯 | B. | 乙烷和苯(C6H6) | ||
| C. | 丁烷和2-甲基丙烷 | D. | 苯和甲苯(C6H5CH3) |
19.三氟化氮(NF3)是无色无味的气体,它可由氨气和氟气反应得到,反应的化学方程式为4NH3+3F2═NF3+3NH4F.下列有关NF3的叙述不正确的是( )
| A. | NF3中N呈+3价 | B. | NF3是共价化合物 | ||
| C. | NF3的氧化性比F2强 | D. | NF3分子呈三角锥形 |
6.有一种巧妙测量人体血液密度的方法,测量前需先用天平和量筒测定几种硫酸铜溶液的密度备用.
(1)测量前,应把天平放在水平台上,当移动游码至零刻度处时,指针偏向分度盘的右侧,则应将平衡螺母向左调,使指针指在分度盘的中央.
(2)接下来的测量步骤如下:
①往烧杯中倒入适量的硫酸铜溶液,测出烧杯和溶液的质量为49.2g;
②将烧杯中的一部分溶液倒入量筒,读出量筒中溶液的体积为20mL;
③测出烧杯和剩余溶液的质量,砝码及游码的位置如图所示.
将下面的实验记录表填写完整:
(3)测定血液密度时,具体操作如下:在几支试管中分别装入密度已知且不等的硫酸铜溶液;然后向每支试管中滴入一滴待测溶液,只要看到哪一支试管中的血液处于悬浮状态,就知道被测血液的密度了,这是为什么?请利用所学知识,简要分析,写出推理过程.分析推理过程:当血液悬浮时,根据物体的浮沉条件可知:G=F浮,ρ物gV物=ρ液gV排,
因为物体悬浮时,V物=V排,
所以:ρ物=ρ液,即血液的密度等于硫酸铜溶液的密度.
(1)测量前,应把天平放在水平台上,当移动游码至零刻度处时,指针偏向分度盘的右侧,则应将平衡螺母向左调,使指针指在分度盘的中央.
(2)接下来的测量步骤如下:
①往烧杯中倒入适量的硫酸铜溶液,测出烧杯和溶液的质量为49.2g;
②将烧杯中的一部分溶液倒入量筒,读出量筒中溶液的体积为20mL;
③测出烧杯和剩余溶液的质量,砝码及游码的位置如图所示.
将下面的实验记录表填写完整:
| 烧杯和溶液的质量/g | 烧杯和剩余溶液的质量/g | 量筒中溶液的质量/g | 量筒中溶液的体积/cm3 | 硫酸铜溶液的密度ρ/(g•cm-3) |
| 49.2 | 28.2 | 21 | 20 | 1.05 |
因为物体悬浮时,V物=V排,
所以:ρ物=ρ液,即血液的密度等于硫酸铜溶液的密度.


 ; G2的结构简式为
; G2的结构简式为
 ;请写出E→F1的化学方程式:
;请写出E→F1的化学方程式: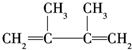 +Br2→
+Br2→