题目内容
12.室温时,将同种规格的铝片分别投入下列物质中,生成氢气的反应速率最大的是( )| A. | 0.1mol/L盐酸15mL | B. | 0.2mol/L盐酸12mL | ||
| C. | 0.15mol/L硫酸8mL | D. | 浓硫酸15mL |
分析 Al与酸反应生成氢气,酸中氢离子浓度越大,反应速率越快,但浓硫酸具有强氧化性,以此来解答.
解答 解:A、B、C中均与Al反应生成氢气,且C中氢离子浓度最大,则反应速率最快,而D中浓硫酸具有强氧化性,不能与Al反应生成氢气,
故选C.
点评 本题考查化学反应速率的影响因素,为高频考点,把握物质的性质、浓度对反应速率的影响为解答的关键,侧重分析与应用能力的考查,注意浓硫酸的强氧化性,题目难度不大.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案
相关题目
2.已知115号元素的一种核素为289X,下列有关叙述正确的是( )
| A. | 115号元素可显+5价 | B. | X原子的中子数与电子数之差为174 | ||
| C. | 115号元素位于周期表第八周期 | D. | 115号元素属于非金属元素 |
17.反应A(g)+3B(g)?2C(g)+2D(g)在四种不同情况下的反应速率如下,其中表示反应速率最快的是( )
| A. | v(A)=0.15mol/(L•min) | B. | v(B)=0.015 mol/(L•s) | ||
| C. | v(C)=0.40 mol/(L•min) | D. | v(D)=0.45 mol/(L•min) |
1.在标准状态下,气体甲和气体乙的密度分别为1.250克/升、1.875克/升,甲、乙的混合气体对氢气的相对密度为16.8,则混合气体中甲和乙的体积比为( )
| A. | 1:1 | B. | 2:1 | C. | 2:3 | D. | 3:2 |
2.下列反应的离子方程式错误的是( )
| A. | 次氯酸钙溶液中通入过量二氧化碳:ClO-+H2O+CO2═HCO3-+HClO | |
| B. | 过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| C. | 硫酸亚铁溶液中加入过氧化氢溶液:Fe2++2H2O2+4H+═Fe3++4H2O | |
| D. | 硝酸铁溶液中加过量氨水:Fe3++3NH3•H2O═Fe(OH)3↓+3NH4+ |
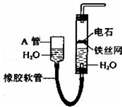 如图所示实验装置可用于制取乙炔.
如图所示实验装置可用于制取乙炔. ”结构存在的同分异构体的数目有( )
”结构存在的同分异构体的数目有( )