题目内容
用下列方法制取O2:①KClO3与MnO2混合受热分解 ②Na2O2加水 ③H2O2中加入MnO2 ④加热KMnO4,若制得相同质量的氧气,上述反应各物质(依编号顺序)的电子转移数目之比为( )
| A、3:2:2:4 |
| B、1:1:1:1 |
| C、2:1:1:2 |
| D、1:2:1:2 |
考点:氧化还原反应的电子转移数目计算
专题:氧化还原反应专题
分析:①氯酸钾分解反应的方程式为2KClO3
2KCl+3O2↑,转移电子是12mol,③②2Na2O2+2H2O═4NaOH+O2↑中转移电子是2mol,2H2O2
2H2O+O2↑,转移电子是2mol,④加热高锰酸钾的方程式为2KMnO4
K2MnO4+MnO2+O2↑,转移电子是4mol,据电子守恒来计算回答.
| ||
| ||
| ||
解答:
解:①氯酸钾分解反应的方程式为2KClO3
2KCl+3O2↑,转移电子是12mol,③②2Na2O2+2H2O═4NaOH+O2↑中转移电子是2mol,2H2O2
2H2O+O2↑,转移电子是2mol,④加热高锰酸钾的方程式为2KMnO4
K2MnO4+MnO2+O2↑,转移电子是4mol,当获得氧气的质量均是32g,即1mol时,转移电子数分别是4mol、2mol、2mol、4mol,所以所转移的电子数目之比是2:1:1:2.
故选C.
| ||
| ||
| ||
故选C.
点评:本题考查学生氧化还原反应中电子转移情况,注意化合价升高数=化合价降低数值=转移电子数这一规律的应用,难度不大.

练习册系列答案
相关题目
已知自然界氧的同位素160、17O、18O,碳酸钙的同位素有16C、18C,从二氧化碳酸饮料分子的原子组成来看.自然界的CO2一共有( )
| A、3种 | B、6种 | C、9种 | D、12种 |
化学与生产、生活、社会密切相关,下列说法正确的是( )
| A、煤经气化和液化两个物理过程后可变为清洁能源,这是煤综合利用的主要方法 |
| B、蛋白质、淀粉、纤维素、油脂等都能在人体内水解并提供能量 |
| C、利用风能发电、使用太阳能热水器、应用无氟制冷剂均有利于降低大气中的二氧化碳 |
| D、塑料袋在全球“失宠”,有偿使用成为风尚,是因为塑料袋填埋占用土地,且难以降解,会造成“白色污染” |
下列化学方程式中,不能用离子方程式Ba2++SO42-═BaSO4 表示的是( )
| A、BaCl2+K2SO4═BaSO4+2 KCl |
| B、Ba(OH)2+K2SO4═BaSO4+2 KOH |
| C、Ba(NO3)2+H2SO4═BaSO4+2 HNO3 |
| D、Ba(OH)2+H2SO4═BaSO4+2 H2O |
两种烃混合,完全燃烧后生成的CO2 的物质的量大于生成的H2O 的物质的量,则这两种烃的组合可能是( )
| A、烷烃和烷烃 |
| B、烯烃和烯烃 |
| C、烯烃和炔烃 |
| D、烷烃和烯烃 |
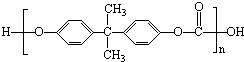 2010年5月1日上海世博会隆重开幕,世博会的环保概念是人们关心的话题,环保材料更为世人瞩目,其中聚碳酸酯是用得较多的材料.聚碳酸酯的结构简式如图所示,下列说法正确的是( )
2010年5月1日上海世博会隆重开幕,世博会的环保概念是人们关心的话题,环保材料更为世人瞩目,其中聚碳酸酯是用得较多的材料.聚碳酸酯的结构简式如图所示,下列说法正确的是( )| A、它在结构上可以看成由碳酸和另一有机物通过缩聚反应而成 |
| B、该有机物是一种高分子化合物,肯定易溶于水 |
| C、它是一种纯净物,属于酯类物质 |
| D、它耐强酸,强碱,不可与强氧化剂发生反应 |
下列实验装置、试剂选用或操作正确的是( )
A、 配制一定浓度的稀硫酸 |
B、 实验室制备氧气 |
C、 实验室制备氨气 |
D、 除去CO2中的HCl |
下列物质中,属于碱的是( )
| A、纯碱 | B、烧碱 |
| C、生石灰 | D、碱式碳酸铜 |