题目内容
4.下列物质中,物质的量最大的是A,含分子个数最多的是A,含原子个数最多的是E,质量最大的是D.(填字母)A、6g氢气
B、0.5mol CO2
C、1.204×1024个氯化氢分子
D、147g硫酸E、92g乙醇(C2H5OH)
分析 根据n=$\frac{m}{M}$计算氢气、硫酸、乙醇的物质的量,根据n=$\frac{N}{{N}_{A}}$计算HCl的物质的量.
根据V=nVm可知,气体的物质的量越大,体积越大,硫酸、乙醇是液体,相同物质的量的体积远远小于气体的体积;
根据N=nNA可知,物质的量越大,含有分子数目越多;
由各物质的量的分子式可知,氢气中氢原子物质的量是氢气的2倍,二氧化碳中原子的物质的量是二氧化碳的3倍,HCl中原子的物质的量等于HCl的2倍,硫酸中原子的物质的量硫酸分子的7倍,乙醇中原子物质的量为乙醇的9倍,据此计算判断;
根据m=nM计算二氧化碳、氯化氢的质量,据此判断.
解答 解:A、6g H2的物质的量为$\frac{6g}{2g/mol}$=3mol,
B、0.5mol CO2,
C、HCl的物质的量为$\frac{1.204×1{0}^{24}}{6.02×1{0}^{23}}$=2mol,
D、147g H2SO4的物质的量为$\frac{147g}{98g/mol}$=1.5mol,
E、92g乙醇的物质的量=$\frac{92g}{46g/mol}$=2mol,
物质的量最大的是6g氢气;硫酸、乙醇是液体,相同物质的量体积远远小于气体,根据V=nVm可知,气体的物质的量越大,体积越大,故体积最大的是6gH2;
氢气中含有原子为3mol×2=6mol,二氧化碳中含有原子为0.5mol×3=1.5mol,HCl中含有原子为2mol×2=4mol,硫酸中含有原子为1.5mol×7=10.5mol,乙醇中含有原子物质的量=2mol×9=18mol,故含有原子最多的是:92g 乙醇;
氢气的质量6g,CO2的质量为0.5mol×44g/mol=22g,HCl的质量为2mol×34g/mol=68g,硫酸的质量147g,乙醇的质量为92g,故质量最大的是:147g 硫酸,
故答案为:A;A;E;D.
点评 本题考查常用化学计量的有关计算,比较基础,注意对公式的理解与运用,注意基础知识的理解掌握.

| 选项 | 实验目的 | 实验方案 |
| A | 检验食盐中是否添加KIO3 | 取食盐试样,溶于KI溶液,加入淀粉溶液,观察溶液是否变蓝 |
| B | 验证硝酸是挥发性酸 | 用两根玻璃棒分别蘸取浓硝酸和浓氨水,然后靠近,观察是否有白烟产生 |
| C | 验证Br2氧化性强于Fe3+ | 取少许FeCl3晶体溶于稀盐酸,加入KSCN观察溶液是否变红,滴入溴水后再观察是否变红 |
| D | 验证氯酸钾中含有氯元素 | 取少量氯酸钾加入MnO2充分加热,残留物溶于水,取上层清液,滴入硝酸酸化的AgNO3溶液,观察是否有白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 1:4 |
| 除杂试剂 | 方法 | |
| C6H6 (C6H5OH) | ||
| C2H6 (C2H4) | ||
| C6H5Br (Br2) | . |
(3)目前出现的“不粘锅”、不粘油的吸油烟机等等新型厨具,其秘密就是表面有一种叫做“特 富隆”的涂层,实际上就是号称“塑料王”的聚四氟乙烯.试写出用四氟乙烯合成“特富隆”的化学方程式及其反应类型.反应方程式:nCF2=CF2→
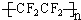 ,类型加聚反应.
,类型加聚反应. | A. | C2H2 | B. | C2H5OH | C. | CH3CHO | D. | CH3COOH |
| A. | 溶质的质量分数为w=$\frac{a}{Vρ-a}$×100% | |
| B. | 上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w | |
| C. | 上述溶液中再加入相同质量的水后,所得溶液的物质的量浓度变为原来一半 | |
| D. | 溶质的物质的量浓度c=$\frac{1000a}{17V}$ mol•L-1 |

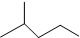 表示的分子式C6H14;名称2-甲基戊烷.
表示的分子式C6H14;名称2-甲基戊烷.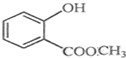 中含有的官能团的名称为酚羟基、酯基.
中含有的官能团的名称为酚羟基、酯基. .3-甲基-2-乙基-1-戊烯结构简式为CH3CH(CH3)CH2C(CH2CH3)=CH2.
.3-甲基-2-乙基-1-戊烯结构简式为CH3CH(CH3)CH2C(CH2CH3)=CH2.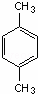 名称为对二甲苯.
名称为对二甲苯.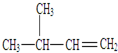 名称为3-甲基-1-丁烯.
名称为3-甲基-1-丁烯.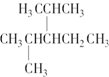 名称为2,4-二甲基-3--乙基戊烷.
名称为2,4-二甲基-3--乙基戊烷.