题目内容
12.某实验小组用下列装置进行乙醇催化氧化的实验.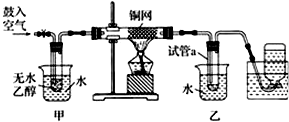
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学反应方程式2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O.
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇氧化反应是放热反应.
(2)甲和乙两个水浴作用不相同.
甲的作用是加热;乙的作用是冷却.
(3)反应进行一段时间后,干燥试管a中能收集到多种物质,它们是乙醛、乙醇、水.集气瓶中收集到的气体的主要成分是氮气.
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有乙酸.要除去该物质,可先在混合液中加入c(填字母).
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
然后,再通过蒸馏(填实验操作名称)即可除去.
分析 实验室探究乙醇的催化氧化反应,可将甲进行水浴加热,能使甲中乙醇平稳气化成乙醇蒸气,则进入铜网的气体为空气和乙醇的混合气体,在加热条件下,分别发生2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O,可观察到铜网出现红色和黑色交替的现象,进入乙中的气体经冷却后,可在试管中得到乙醛、乙醇和水,而集气瓶中收集的气体主要为氮气,另外如乙酸的酸性比碳酸强,则在碳酸钠溶液中加入乙酸,可生成二氧化碳气体,以此解答该题.
解答 解:(1)进入乙中的气体为空气和乙醇,加热时,铜和氧气反应生成氧化铜,方程式为2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,氧化铜和乙醇在加热条件下发生氧化还原反应可生成乙醛和铜,反应的方程式为CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O,实验时,先加热玻璃管乙中的镀银钢丝,约1分钟后鼓入空气,此时铜丝即呈红热状态,若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束,说明反应引发后,不需加热即可进行到底,说明该反应是放热的反应,
故答案为:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O;放热;
(2)甲装置常常浸在温度为70~80的水浴中,水浴能使容器受热均匀,能使甲中乙醇平稳气化成乙醇蒸气,生成的乙醛以及剩余的乙醇可在乙中经冷却而收集,
故答案为:冷却;
(3)乙醇催化氧化生成乙醛和水,乙醇蒸气冷却后为液体;空气中的氧气反应,所以最后收集的其他主要为氮气,
故答案为:乙醛、乙醇、水;氮气;
(4)乙酸易溶于水和有机溶剂,可与碳酸氢钠溶液反应生成乙酸钠,可用碳酸氢钠溶液除杂,在反应后得到产物中加热碳酸氢钠,蒸馏可将乙醇、乙醛分离,
故答案为:c;蒸馏.
点评 本题以乙醇的催化氧化为载体,综合考查学生的分析能力和实验能力,为高考常见题型,注意把握实验的原理以及操作方法,难度不大.

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案| A. | 标况下,11.2 L氯气完全溶于1 L水中,所得溶液中Cl-和ClO-两种粒子数之和为NA | |
| B. | 80 mL 10 mol/L盐酸与足量 MnO2加热反应,产生Cl2分子数为0.2NA | |
| C. | S2和S8的混合物共6.4 g,其中所含硫原子数一定为 0.2 NA | |
| D. | 含有4 NA个C-C 键的金刚石,其质量为 12 g |
| A. | CuSO4、Na2SO4、BaSO4三种粉末 | B. | CuSO4、(NH4)2SO4、Na2SO4三种粉末 | ||
| C. | 汽油、乙醇、四氯化碳三种液体 | D. | NaOH、NH4NO3、NaCl三种晶体. |
| A. | 甲苯不能使溴的四氯化碳溶液褪色 | B. | 甲苯能使酸性高锰酸钾溶液褪色 | ||
| C. | 甲苯在30℃时硝化生成硝基甲苯 | D. | 1 mol甲苯与3 molH2发生加成反应 |

| A. | 1mol CPAE与足量的NaOH溶液、溴水反应,分别最多消耗3mol | |
| B. | 可用金属Na检测上述反应是否残留苯乙醇 | |
| C. | 与苯乙醇互为同分异构体的酚类物质共有9种 | |
| D. | 咖啡酸可发生聚合反应,并且其分子中含有3种含氧官能团 |
| A. | 100毫升的溶液中含有Mg2+、Cl-总数为0.3NA | |
| B. | 100毫升的溶液中含有Mg2+数目是0.1NA | |
| C. | 1升溶液中Mg2+的浓度是0.3mol/L | |
| D. | 1.5升溶液中含有Cl-的浓度是4.5mol/L |
 按要求填空.
按要求填空. .
.