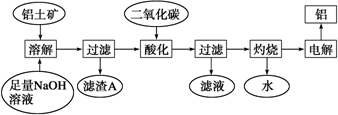
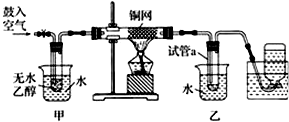
题目内容
20.NA代表阿伏加德罗常数,下列说法中正确的是( )| A. | 标况下,11.2 L氯气完全溶于1 L水中,所得溶液中Cl-和ClO-两种粒子数之和为NA | |
| B. | 80 mL 10 mol/L盐酸与足量 MnO2加热反应,产生Cl2分子数为0.2NA | |
| C. | S2和S8的混合物共6.4 g,其中所含硫原子数一定为 0.2 NA | |
| D. | 含有4 NA个C-C 键的金刚石,其质量为 12 g |
分析 A、氯气与水反应是可逆反应,不可能反应完全;
B.浓盐酸变成稀盐酸后,反应停止,反应生成的氯气减少;
C.都是单质,则硫原子的物质的量为$\frac{6.4g}{32g/mol}$=0.2mol;
D.1mol金刚石含有2NA个碳碳键,4NA个碳碳键的金刚石2mol;
解答 解:A、氯气与水反应是可逆反应,不可能反应完全,所得溶液中Cl-和ClO-两种粒子数之和小于NA,故A错误;
B.80mL 10mol•L-1盐酸中含有0.8mol氯化氢,消耗0.8mol氯化氢能够生成0.2mol氯气,由于随着反应的进行,浓盐酸会变成稀盐酸,反应停止,则反应生成的氯气小于0.2mol,产生氯气的分子数小于0.2NA,故B错误;
C.S2和S8的混合物中只有S原子,则硫原子的物质的量为$\frac{6.4g}{32g/mol}$=0.2mol,则所含硫原子数一定为0.2NA,故C正确;
D.1mol金刚石含有2NA个碳碳键,4NA个碳碳键的金刚石2mol,质量为24g,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,熟练掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项B为易错点,注意浓盐酸与二氧化锰的反应中,浓盐酸变成稀盐酸后反应停止.

练习册系列答案
相关题目
10.化学式为C4H8O3的有机物,在浓硫酸存在和加热时,有如下性质:
①能分别与CH3CH2OH和CH3COOH反应,
②脱水生成一种能使溴水褪色的物质,此物质只存在一种结构简式,
③能生成一种分子式为C4H6O2的五元环状化合物,
则C4H8O3的结构简式为( )
①能分别与CH3CH2OH和CH3COOH反应,
②脱水生成一种能使溴水褪色的物质,此物质只存在一种结构简式,
③能生成一种分子式为C4H6O2的五元环状化合物,
则C4H8O3的结构简式为( )
| A. | HOCH2COOCH2CH3 | B. | CH3CH(OH)CH2COOH | C. | CH3CH2CH(OH)COOH | D. | HOCH2CH2CH2COOH |
11.下列表示物质结构的化学用语或模型正确的是( )
| A. | 苯(C6H6)分子的比例模型: | B. | CO2的电子式: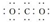 | ||
| C. | Cl-离子的结构示意图: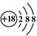 | D. | 乙烯的结构式:CH2=CH2 |
8.以下是“海带中碘元素的分离及检验”实验过程中某个环节中的实验步骤,其中正确的是( )
| A. | 将干海带用蒸馏水泡发 | |
| B. | 将海带灰用蒸馏水浸泡,取其浸取液,向其中加入四氯化碳 | |
| C. | 向海带灰的浸取液中,加入少量稀硫酸和过氧化氢溶液 | |
| D. | 将海带灰的浸取液加入分液漏斗中进行分液分离 |
12.下列依据相关实验得出的结论正确的是( )
| A. | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,则该溶液一定是钠盐溶液 | |
| B. | 测定同温同浓度的Na2CO3和Na2SiO3溶液的pH,发现Na2SiO3溶液的pH大,则碳的非金属性强于硅 | |
| C. | 淀粉与稀硫酸混合加热一段时间,滴加银氨溶液并水浴加热,无银镜出现,则淀粉没有水解 | |
| D. | 向浓度均为0.1 mol•L-1 NaCl和NaI混合溶液中滴加少量稀AgNO3溶液,出现黄色沉淀,说明Ksp(AgCl)>Ksp(AgI) |
13.将锌片和铜片用导线连接置于稀硫酸溶液中,下列各叙述错误的是( )
| A. | 铜片作正极 | B. | 正极反应为:2H++2e-═H2↑ | ||
| C. | 溶液中的H+移向正极 | D. | 锌片作负极,锌发生还原反应 |