题目内容
17.下列说法正确的是( )| A. | 一定物质的量浓度的溶液配制过程中,仰视定容,所得溶液的浓度偏大 | |
| B. | 相同体积和相同物质的量浓度的不同溶液里所含溶质的物质的量相同 | |
| C. | 溶液中溶质质量分数为w,密度为ρ g/cm3,溶质摩尔质量为M g/mol的溶液的物质的量浓度为$\frac{pw}{M}$mol/L | |
| D. | 10 mol/L的浓盐酸与H2O等质量混合所得混合液的浓度为5 mol/L |
分析 B.根据n=cV判断;
D.稀盐酸密度小于浓盐酸密度,稀盐酸质量为浓盐酸质量的2倍,则稀盐酸体积大于浓盐酸体积的2倍;
C.根据c=$\frac{1000ρW}{M}$计算;
A.定容仰视,液面在刻度线上方,配制溶液体积偏大.
解答 解:A.定容仰视,液面在刻度线上方,配制溶液体积偏大,所配溶液浓度偏小,故A错误;
B.相同体积和相同物质的量浓度的不同溶液,根据n=cV可知所含溶质的物质的量相同,故B正确;
C.溶液中溶质质量分数为w,密度为ρ g•cm-3,溶质摩尔质量为M g•mol-1,根据c=$\frac{1000ρw}{M}$可知,溶液的物质的量浓度为$\frac{1000ρw}{M}$mol/L,故C错误;
D.稀盐酸密度小于浓盐酸密度,稀盐酸质量为浓盐酸质量的2倍,则稀盐酸体积大于浓盐酸体积的2倍,故所得混合液的浓度小于5 mol/L,故D错误;
故选:B.
点评 本题考查物质的量浓度有关计算、一定物质的量浓度溶液配制误差分析,注意理解掌握物质的量浓度与质量分数关系.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.设NA为阿伏加德罗常数值.下列有关叙述正确的是( )
| A. | 标准状况下,5.6L二氧化碳气体中含有的氧原子数为0.5NA | |
| B. | 0.1L0.5mol/LCH3COOH溶液中含有的氢离子数为0.05NA | |
| C. | 1molFe溶于过量硝酸,电子转移数为2NA | |
| D. | 标准状况下,2.24LCC14含有的共价键数为0.4NA |
12.一定条件下,一种反应物过量而另一种反应物仍不能完全反应的是( )
| A. | 氧气和二氧化硫 | B. | 盐酸和锌粒 | C. | 浓硝酸和铜屑 | D. | 醋酸和烧碱 |
9. 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)?CH3OH(g)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)?CH3OH(g)
(1)该反应的平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$
(2)下列各项中,不能够说明该反应已达到平衡的是bd
a.恒温、恒容条件下,容器内的压强不发生变化
b.恒温、恒容条件下,容器内的气体密度不发生变化
c.一定条件下,CO、H2和CH3CH的浓度保持不变
d.一定条件下,单位时间内生成1mol H2,同时生成1mol CH3OH
e.混合气体的平均相对分子质量不再变化
(3)下表所列数据是该反应在不同温度下的化学平衡常数(K)
①若容器容积不变,可增加甲醇产率的措施是降低温度或及时分离甲醇.
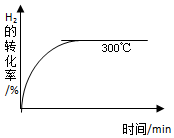
②其他条件相同时,在上述三个温度下分别发生该反应.300℃时,H2的转化率随时间的变化如图所示,请补充完成250℃时H2的转化率随时间的变化示意图.
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-a kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=-b kJ•mol-1
③H2O(g)=H2O(l)△H=-c kJ•mol-1
则 CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=$\frac{b-a-4c}{2}$ kJ•mol-1.
 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)?CH3OH(g)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)?CH3OH(g)(1)该反应的平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$
(2)下列各项中,不能够说明该反应已达到平衡的是bd
a.恒温、恒容条件下,容器内的压强不发生变化
b.恒温、恒容条件下,容器内的气体密度不发生变化
c.一定条件下,CO、H2和CH3CH的浓度保持不变
d.一定条件下,单位时间内生成1mol H2,同时生成1mol CH3OH
e.混合气体的平均相对分子质量不再变化
(3)下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②其他条件相同时,在上述三个温度下分别发生该反应.300℃时,H2的转化率随时间的变化如图所示,请补充完成250℃时H2的转化率随时间的变化示意图.
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-a kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=-b kJ•mol-1
③H2O(g)=H2O(l)△H=-c kJ•mol-1
则 CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=$\frac{b-a-4c}{2}$ kJ•mol-1.
6.下列物质中,属于强电解质的是( )•
| A. | NH3•H2O | B. | BaSO4 | C. | 蔗糖 | D. | 稀硫酸 |
7.做化学实验时,必须十分重视安全和环保问题.下列操作方法不符合上述要求的是( )
| A. | 钠、镁等金属着火,不可用CO2灭火 | |
| B. | 在气体发生装置上点燃氢气等气体时,必须先检验气体的纯度 | |
| C. | 实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室 | |
| D. | 给试管中的液体加热时,不停沿试管倾斜方向移动试管或加入碎瓷片,以免液体暴沸伤人 |