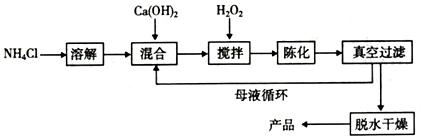
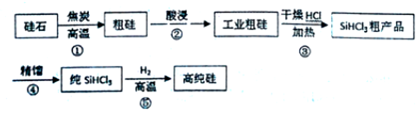
题目内容
5.铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质.在一定温度下,氧化铁可以与CO发生反应:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g),请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:①CO或(CO2)的生成速率与消耗速率相等②CO(或CO2)的质量不再改变.分析 反应达到平衡的标志是正逆反应速率相同,各组分含量保持不变分析,由此分析解答.
解答 解:反应达到平衡的标志是正逆反应速率相同,各组分含量保持不变,所以一氧化碳或二氧化碳的消耗速率和生成速率相同说明平衡,或一氧化碳或二氧化碳的质量分数不变,故答案为:CO或(CO2)的生成速率与消耗速率相等;CO(或CO2)的质量不再改变;CO或CO2的浓度保持不变.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
15.用低品位铜矿(含CuS、CuO以及杂质FeO及Fe2O3)可制备有机催化剂CuCl,其主要流程如图:

已知:Fe3+、Mn2+、Cu2+生成氢氧化物沉淀时的pH
回答下列问题
(1)浸取时,被MnO2氧化的元素有S和Fe(填元素符号),CuS被MnO2及硫酸浸取的离子方程式为CuS+MnO2+4H+=Cu2++Mn2++S↓+2H2O.
(2)步骤③调整pH的范围为3.7≤pH<4.7,滤渣A的成分为Fe(OH)3(填化学式).
(3)“沉铁”时,需要进行过滤洗涤,检验洗涤是否完全的方法是取少量最后一次的洗涤过滤液于试管中,向其中滴加KSCN溶液(BaCl2溶液),若溶液不显红色(无白色沉淀),则表明已洗涤完全.
(4)准确称取所制备的氯化亚铜样品1.600g,将其置于足量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用0.1000mol•L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液25.00mL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为93.3%.

已知:Fe3+、Mn2+、Cu2+生成氢氧化物沉淀时的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Mn(OH)2 | 7.1 | 10.1 |
| Cu(OH)2 | 4.7 | 6.7 |
(1)浸取时,被MnO2氧化的元素有S和Fe(填元素符号),CuS被MnO2及硫酸浸取的离子方程式为CuS+MnO2+4H+=Cu2++Mn2++S↓+2H2O.
(2)步骤③调整pH的范围为3.7≤pH<4.7,滤渣A的成分为Fe(OH)3(填化学式).
(3)“沉铁”时,需要进行过滤洗涤,检验洗涤是否完全的方法是取少量最后一次的洗涤过滤液于试管中,向其中滴加KSCN溶液(BaCl2溶液),若溶液不显红色(无白色沉淀),则表明已洗涤完全.
(4)准确称取所制备的氯化亚铜样品1.600g,将其置于足量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用0.1000mol•L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液25.00mL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为93.3%.
10.钠及其化合物具有广泛的用途.
(1)常温下,浓度均为0.1mol/L的下列五种钠盐溶液的pH如表;
上述盐溶液中的阴离子,结合氢离子能力最强的是CO32-;根据表中数据,浓度均为0.01mol/L的下列四种酸的溶液分别稀释100倍,pH变化最大的是C(填序号).
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)有①100mL0.1mol/L碳酸氢钠 ②100mL0.1mol/L碳酸钠两种溶液,溶液中水电离出的氢离子个数:①<②(填“>”“=”“<”下同);溶液中阴离子的物质的量浓度之和:①<②.
(3)实验室中常用氢氧化钠来进行洗气和提纯.
①当150mL1mol/L的氢氧化钠溶液吸收标况下2.24L二氧化碳时,所得溶液中各离子浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有.
②几种离子开始沉淀时的pH如表:
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加氢氧化钠溶液时,Cu2+(填离子符号)先沉淀,Ksp[Fe(OH)3]<Ksp[Mg(OH)2](填“>”“=”或“<”),要使0.2mol/L硫酸铜溶液中铜离子沉淀较为完全(使铜离子浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液pH为6.( Ksp[Cu(OH)2]=2×10-20 )
(1)常温下,浓度均为0.1mol/L的下列五种钠盐溶液的pH如表;
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)有①100mL0.1mol/L碳酸氢钠 ②100mL0.1mol/L碳酸钠两种溶液,溶液中水电离出的氢离子个数:①<②(填“>”“=”“<”下同);溶液中阴离子的物质的量浓度之和:①<②.
(3)实验室中常用氢氧化钠来进行洗气和提纯.
①当150mL1mol/L的氢氧化钠溶液吸收标况下2.24L二氧化碳时,所得溶液中各离子浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有.
②几种离子开始沉淀时的pH如表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
17.下列说法正确的是( )
| A. | 一定物质的量浓度的溶液配制过程中,仰视定容,所得溶液的浓度偏大 | |
| B. | 相同体积和相同物质的量浓度的不同溶液里所含溶质的物质的量相同 | |
| C. | 溶液中溶质质量分数为w,密度为ρ g/cm3,溶质摩尔质量为M g/mol的溶液的物质的量浓度为$\frac{pw}{M}$mol/L | |
| D. | 10 mol/L的浓盐酸与H2O等质量混合所得混合液的浓度为5 mol/L |
14.下列物质不属于有机物的是( )
| A. | Na2CO3 | B. | CH3CH2OH | C. | CH2=CH2 | D. | CH3COOH |
15.以下几个热化学方程式,能表示有关物质燃烧时的燃烧热的热化学方程式是( )
| A. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=+110.5 kJ•mol-1 | |
| B. | C(s)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 | |
| D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8 kJ•mol-1 |