题目内容
18.已知①中国古代四大发明之一的黑火药,它是由硫磺、木炭粉和硝石组成;②油条中铝含量超标十分普遍,是影响人们健康的食品安全隐患.油条无铝配方由碳酸氢钠(小苏打)和臭粉组成.下列关于硝石和臭粉的成份组合正确的是( )| A. | KNO3、NH4HCO3 | B. | KNO3、Na2CO3 | C. | HNO3、(NH4)2CO3 | D. | NH4NO3、Na2CO3 |
分析 黑火药是我国古代的四大发明之一,它是硝酸钾、硫粉、木炭粉按一定比例混合而成的,硝石是指硝酸钾,油条无铝配方由碳酸氢钠(小苏打)和臭粉组成,碳酸氢铵能说出刺激性气味的氨气.
解答 解:黑火药是我国古代的四大发明之一,它是硝酸钾、硫粉、木炭粉按一定比例混合而成的,硝石是指硝酸钾,油条无铝配方由碳酸氢钠(小苏打)和臭粉组成,碳酸氢铵能说出刺激性气味的氨气,臭粉组成为NH4HCO3,硝石和臭粉的成份组合为:KNO3、NH4HCO3 ,故选A.
点评 本题考查化学与生产、生活的关系,题目难度不大,要求学生能够用化学知识解释化学现象,试题培养了学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.一定条件下,24mL的CO2和N2的混合气体通过足量的过氧化钠粉末,充分反应后得到相同状况下的气体20mL,则原混合气体中CO2的体积分数为( )
| A. | 33.3% | B. | 44% | C. | 56% | D. | 66.7% |
9.在标准状况下,把22.4LNO,NO2的混合气体通入装有1L水的密闭容器中,再向该容器中充入足量的O2,完全反应后(假设反应过程中液体体积不变),容器中所得的溶液的物质的量浓度为( )
| A. | 无法计算 | B. | 1mol•L-1 | C. | 0.5mol•L-1 | D. | 1.5mol•L-1 |
13.下列有关说法正确的是( )
| A. | 工业上通常用电解钠、铁、铜对应的氯化物来制备这三种金属的单质 | |
| B. | 陶瓷、玻璃、水泥属于传统无机硅酸盐材料 | |
| C. | “丹砂(HgS)烧之成水银,积变又还成了“丹砂”,该过程无氧化还原反应发生 | |
| D. | “青篙一握,以水二升渍,绞取汁”屠呦呦对青蒿素的提取属于化学变化 |
3.对下列叙述的评价合理的是( )
| 选项 | 叙述 | 评价 |
| A | 乙酸乙酯在H218O中水解,产物乙醇中将含有18O | 错,根据酯的水解规律,产物乙酸中将含有18O同位素,而乙醇则没有 |
| B | 明矾和漂白粉都可用于水的净化 | 对,二者的作用原理相同 |
| C | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 | 对,K2CO3与NH4Cl反应生成氨气会降低肥效 |
| D | 可以用新制的Cu(OH)2悬浊液鉴别乙醇溶液、乙酸溶液和葡萄糖溶液 | 错,用新制的Cu(OH)2悬浊液不能鉴别乙醇溶液和乙酸溶液 |
| A. | A | B. | B | C. | C | D. | D |
10.下列仪器为冷凝管的是( )
| A. |  | B. |  | C. |  | D. |  |
7.根据能量变化示意图,下列说法正确的是( )
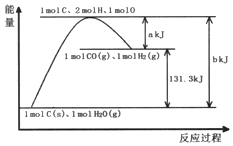

| A. | 1molC和1molH2O反应生成1molCO和1molH2一定吸收131.3kJ的热量 | |
| B. | 反应的热化学方程式可表示为C(s)+H2O(g)═CO(g)+H2(g)△H=(a-b)KJ/mol | |
| C. | 该反应过程反应物断键吸收的能量要小于生成物成键放出的能量 | |
| D. | 加入适当的催化剂,可以加快正、逆反应速率 |
17.以下配制溶液叙述正确的是( )
| A. | 配制一定物质的量浓度溶液时,若加水超容最瓶刻度应用胶头滴管将多余溶液吸出 | |
| B. | 用容量瓶配制溶液,定容时俯视读数,所配溶液浓度偏大 | |
| C. | 欲配制1L1.0mol/L的NaCl溶液,可将58.5gNaCl溶于IL水中 | |
| D. | 稀释后的H2SO4未等冷却至室温可立即转移到容最瓶中 |
