题目内容
1. 氨气是化学实验室常需制取的气体.实验室制取氨气通常有两种方法:
氨气是化学实验室常需制取的气体.实验室制取氨气通常有两种方法:①用固体氢氧化钙与氯化铵共热;
②在常温下用固体氢氧化钠与浓氨水反应.
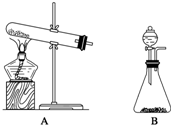
(1)下面的制取装置图中,方法①应选用装置A(填“A”或“B”,下同),方法②应选用装置B.
(2)写出加热NH4Cl和Ca(OH)2制取NH3的反应方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(3)在制取后,如果要干燥氨气,应选用的干燥剂是B.
A.浓硫酸 B.固体氢氧化钠 C.五氧化二磷
(4)检验集气瓶中是否收集满氨气的方法是将湿润的红色石蕊试纸靠近集气瓶口,若试纸变蓝,说明NH3已集满.
分析 (1)用固体氢氧化钙与氯化铵共热制备氨气,是固体和固体加热制备气体的反应,在常温下用固体氢氧化钠与浓氨水反应是固体和液体不加热制备气体;
(2)制取NH3的反应为加热NH4Cl和Ca(OH)2 反应生成氯化钙、氨气和水;
(3)氨气是碱性气体,不能用酸性干燥剂干燥,应用碱性干燥剂;
(4)氨气是碱性气体,遇到湿润的红色石蕊试纸变蓝色检验.
解答 解:(1)用固体氢氧化钙与氯化铵共热制备氨气,是固体和固体加热制备气体的反应,应选择A装置,在常温下用固体氢氧化钠与浓氨水反应是固体和液体不加热制备气体.应选择B装置,
故答案为:A;B;
(2)制取NH3的反应为加热NH4Cl和Ca(OH)2 反应生成氯化钙、氨气和水,反应的化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2;
(3)A.浓硫酸和氨气反应生成硫酸铵,不能干燥氨气,故A错误;
B.固体氢氧化钠具有吸湿性,可以干燥氨气,故B正确;
C.五氧化二磷和氨气发生反应,不能干燥氨气,故C错误;
故答案为:B;
(4)用湿润的红色石蕊试纸靠近集气瓶口,如果试纸变蓝,则证明是氨气收集慢,
故答案为:将湿润的红色石蕊试纸靠近集气瓶口,若试纸变蓝,说明NH3已集满.
点评 本题考查氨的实验探究,题目难度不大,注意实验室制备氨气的所用药品,氨气的检验方法.

练习册系列答案
相关题目
2.橙花醇具有玫瑰及苹果香气,可作为香料.其结构简式如图:
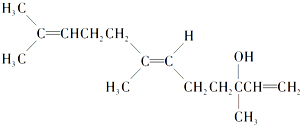
下列关于橙花醇的叙述,错误的是( )

下列关于橙花醇的叙述,错误的是( )
| A. | 既能发生取代反应,也能发生加成反应 | |
| B. | 在浓硫酸催化下加热脱水,可以生成不止一种四烯烃 | |
| C. | 1mol橙花醇在氧气中充分燃烧,需消耗448 L氧气(标准状况) | |
| D. | 1mol橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗3mol溴 |
19.下列物质中不属于高分子化合物的是( )
| A. | 蛋白质 | B. | 硝酸甘油脂 | C. | 硝酸纤维素脂 | D. | 天然橡胶 |
10.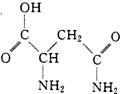 芦笋中的天冬酰胺(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效.
芦笋中的天冬酰胺(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效.
(1)天冬酰胺所含元素中,氮(填元素名称)元素基态原子核外未成对电子数最多.
(2)天冬酰胺中碳原子的杂化轨道类型有sp3、sp2.
(3)H2Se的晶体类型为分子晶体,含有的共价键类型为极性共价键.
(4)已知钼(Mo)位于第五周期、ⅥB族,钼、铬、锰的部分电离能如表所示:
A是Mn(填元素符号),B原子的价电子排布式为3d54s1.
 芦笋中的天冬酰胺(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效.
芦笋中的天冬酰胺(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效.(1)天冬酰胺所含元素中,氮(填元素名称)元素基态原子核外未成对电子数最多.
(2)天冬酰胺中碳原子的杂化轨道类型有sp3、sp2.
(3)H2Se的晶体类型为分子晶体,含有的共价键类型为极性共价键.
(4)已知钼(Mo)位于第五周期、ⅥB族,钼、铬、锰的部分电离能如表所示:
| 编号 | I5/kJ•mol-1 | I6/kJ•mol-1 | I7/kJ•mol-1 | I8/kJ•mol-1 |
| A | 6990 | 9220 | 11500 | 18700 |
| B | 6702 | 8745 | 15455 | 17820 |
| C | 5257 | 6641 | 12125 | 13860 |
11.实验室常利用以下反应制取少量氮气:NaNO2+NH4Cl═NaCl+N2↑+2H2O关于该反应的下列说法正确的是( )
| A. | NaNO2是氧化剂 | |
| B. | 每生成1 mol N2时,转移电子数目为6NA | |
| C. | NH4Cl中的氮元素被还原 | |
| D. | N2既是氧化剂,又是还原剂 |
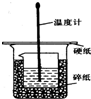 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程 中放出的热量可计算中和热.回答下列问题:
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程 中放出的热量可计算中和热.回答下列问题: