题目内容
1.为确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验.(1)称取a g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为b L,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)称取同样的a g样品,在高温下恰好完全反应.
(3)待(2)中反应产物冷却后,加入足量盐酸,测得生成的气体体积为c L,该气体与(1)中所得气体的体积比,c:b为2:3.
根据上述实验可确定该铝热剂中含Al的质量分数为32.4%.
分析 (1)铝热剂是金属铝和氧化铁的混合物,金属铝可以和氢氧化钠之间反应生成偏铝酸钠和氢气;
(2)金属铁可以和盐酸反应生成氯化亚铁和氢气,根据金属的量之比确定氢气的量之比.
解答 解:(1)铝热剂是金属铝和氧化铁的混合物,金属铝可以和氢氧化钠之间反应生成偏铝酸钠和氢气,即2Al+2NaOH+2H2O=2NaAlO2+3H2↑,离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,根据方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,当生成的氢气(标准状况,下同)体积为bL时,则样品中Al的质量为:$\frac{b}{22.4}×\frac{2}{3}$momol×27g/mol=$\frac{45b}{56}$g,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)根据反应:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,铝的物质的量是$\frac{b}{22.4}×\frac{2}{3}$mol=$\frac{b}{33.6}$mol,产生铁的物质的量是$\frac{b}{33.6}$mol,这些铁产生氢气的物质的量是$\frac{b}{33.6}$mol,即c=$\frac{b}{33.6}$mol×22.4L/mol=$\frac{2b}{3}$,所以c:b=2:3,铁的质量为:$\frac{b}{33.6}$×56g,所以Al的质量分数为$\frac{\frac{45b}{56}}{\frac{56b}{33.6}+\frac{45b}{56}}×100%$=32.4%,
故答案为:2:3;32.4%.
点评 本题考查学生铝热反应的有关知识,注意金属铝可以和氢氧化钠反应生成氢气这一性质,难度不大.

| A. | NO、O2、NO2分子数目比是2:1:2 | |
| B. | 反应混合物中各组分物质的浓度相等 | |
| C. | 混合气体的总质量不变 | |
| D. | 混合气体的平均相对分子质量不变 |
| A. | CS2 | B. | Na2O2 | C. | CaO | D. | CH3COOH |
| A. | SiC俗称金刚砂,可用作砂纸、砂轮的磨料 | |
| B. | 金属铝熔点高,所以我们可以用铝制器皿煮饭 | |
| C. | 硅酸钠俗称水玻璃,可用作黏合剂和木材防火剂 | |
| D. | 二氧化硫有毒,严禁将其添加到任何食品和饮料中 |
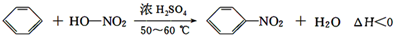
存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯,有关数据如表:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | 83 | 1.4 | 易溶于水 | |
| 浓硫酸 | 338 | 1.84 | 易溶于水 |
取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混合液,将混合酸小心加入B中,把17.73mL(15.6g)苯加入A中.向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀,在50~60℃下发生反应,直至反应结束.
将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5% NaOH溶液和水洗涤.分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210℃馏分,得到纯硝酸基苯18.45g.回答下列问题:
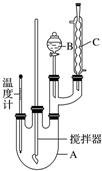
(1)装置B的名称是分液漏斗,装置C的作用是冷凝回流;
(2)配制混合液时,不能(填“能”或“不能”)将浓硝酸加入到浓硫酸中,说明理由:容易发生迸溅;
(3)为了使反应在50~60℃下进行,常用的方法是水浴加热;
(4)在洗涤操作中,第二次水洗的作用是洗去残留的NaOH及生成的盐;
(5)本实验所得到的硝基苯产率是75%(保留两位有效数字).
| A. | HCO3-+H2O?H2CO3+OH- | B. | HS-+H2O?S2-+H3O- | ||
| C. | HCO3-+H2O?H3O++CO32- | D. | H3PO4?3H++PO43+ |
| A. | 塑料 | B. | 蛋白质 | C. | 合成纤维 | D. | 合成橡胶 |
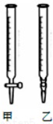 某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:①用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是(填编号)①.
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入乙中.(从图中选填“甲”或“乙”)
(3)下列操作会引起实验结果偏大的是:B(填编号)
A.在锥形瓶装液前,留有少量蒸馏水
B.滴定前,滴定管尖嘴有气泡,滴定后无气泡
C.锥形瓶先用蒸馏水洗涤后,未用待测液润洗
D.用酸式滴定管量取液体时,释放液体前滴定管前端有气泡,之后消失
(4)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视锥形瓶内颜色.判断到达滴定终点的现象是:锥形瓶中溶液由无色变成浅红色,且半分钟内不变色.
(5)以下是实验数据记录表
| 滴定次数 | 盐酸体积mL | NaOH溶液体积读数(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 21.30 |
| 2 | 20.00 | 0.00 | 16.30 |
| 3 | 20.00 | 0.00 | 16.32 |
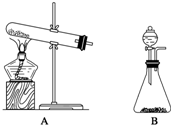 氨气是化学实验室常需制取的气体.实验室制取氨气通常有两种方法:
氨气是化学实验室常需制取的气体.实验室制取氨气通常有两种方法: