题目内容
19.下列物质中不属于高分子化合物的是( )| A. | 蛋白质 | B. | 硝酸甘油脂 | C. | 硝酸纤维素脂 | D. | 天然橡胶 |
分析 高分子化合物是指那些由众多原子或原子团主要以共价键结合而成的相对分子量在一万以上的化合物,多为高聚物.
解答 解:硝酸纤维素脂、天然橡胶以及蛋白质的都属于高聚物,相对分子质量在一万以上,而硝酸甘油脂的相对分子质量较小,不属于高分子化合物,故选B.
点评 本题考查高分子化合物知识,题目难度不大,注意把握高分子化合物的概念和性质.

练习册系列答案
相关题目
9.下列有关物质用途或性质的叙述中正确的是( )
| A. | SiC俗称金刚砂,可用作砂纸、砂轮的磨料 | |
| B. | 金属铝熔点高,所以我们可以用铝制器皿煮饭 | |
| C. | 硅酸钠俗称水玻璃,可用作黏合剂和木材防火剂 | |
| D. | 二氧化硫有毒,严禁将其添加到任何食品和饮料中 |
10.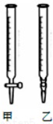 某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是(填编号)①.
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入乙中.(从图中选填“甲”或“乙”)
(3)下列操作会引起实验结果偏大的是:B(填编号)
A.在锥形瓶装液前,留有少量蒸馏水
B.滴定前,滴定管尖嘴有气泡,滴定后无气泡
C.锥形瓶先用蒸馏水洗涤后,未用待测液润洗
D.用酸式滴定管量取液体时,释放液体前滴定管前端有气泡,之后消失
(4)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视锥形瓶内颜色.判断到达滴定终点的现象是:锥形瓶中溶液由无色变成浅红色,且半分钟内不变色.
(5)以下是实验数据记录表
通过计算可得,该盐酸浓度为:0.1631 mol•L-1(计算结果保留4位小数)
 某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:①用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是(填编号)①.
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入乙中.(从图中选填“甲”或“乙”)
(3)下列操作会引起实验结果偏大的是:B(填编号)
A.在锥形瓶装液前,留有少量蒸馏水
B.滴定前,滴定管尖嘴有气泡,滴定后无气泡
C.锥形瓶先用蒸馏水洗涤后,未用待测液润洗
D.用酸式滴定管量取液体时,释放液体前滴定管前端有气泡,之后消失
(4)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视锥形瓶内颜色.判断到达滴定终点的现象是:锥形瓶中溶液由无色变成浅红色,且半分钟内不变色.
(5)以下是实验数据记录表
| 滴定次数 | 盐酸体积mL | NaOH溶液体积读数(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 21.30 |
| 2 | 20.00 | 0.00 | 16.30 |
| 3 | 20.00 | 0.00 | 16.32 |
7.下列叙述中错误的是( )
| A. | 煤是工业上获得苯、甲苯、二甲苯等芳香烃的重要来源物质 | |
| B. | 海水提溴、海带提碘的过程均不涉及化学变化 | |
| C. | 铝热反应放出大量的热,金属铝做还原剂 | |
| D. | 通过催化重整,可从石油中获取环状烃 |
14.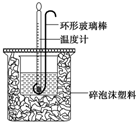 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和右图所示装置进行测定中和热的实验,得到表中的数据
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和右图所示装置进行测定中和热的实验,得到表中的数据
(1)碎泡沫塑料的作用是保温隔热,减少热量损失环形玻璃搅拌棒可不可以用铜丝搅拌棒代替,为什么不可以;铜的导热性好,易损失热量产生误差
(2)该实验测得的中和热数值为56.8 kJ•mol-1,(盐酸和NaOH溶液的密度按1g•cm-3计算,反应后混合溶液的比热容(c)按4.18J•(g•℃)-1计算).
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热的数值偏小(“偏大”、“偏小”或“不变”)
 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和右图所示装置进行测定中和热的实验,得到表中的数据
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和右图所示装置进行测定中和热的实验,得到表中的数据| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃[来源:Z,xx,k.Com] | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.3 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 20.5 | 20.6 | 24.9 |
(2)该实验测得的中和热数值为56.8 kJ•mol-1,(盐酸和NaOH溶液的密度按1g•cm-3计算,反应后混合溶液的比热容(c)按4.18J•(g•℃)-1计算).
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热的数值偏小(“偏大”、“偏小”或“不变”)
18.关于氢键,下列说法正确的是( )
| A. | 由于冰中的水分子间存在氢键,所以其密度大于液态水 | |
| B. | 可以用氢键解释接近沸点的水蒸气的相对分子质量测定值比用化学式(H2O)计算出来的相对分子质量大 | |
| C. | 分子间氢键和分子内氢键都会使熔沸点升高 | |
| D. | 每一个水分子内平均含有两个氢键 |
19.下列物质的分类正确的是( )
| A. | NO--酸性氧化物 | B. | 液氯--非电解质 | C. | 小苏打--酸式盐 | D. | 纯碱--碱 |
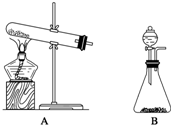 氨气是化学实验室常需制取的气体.实验室制取氨气通常有两种方法:
氨气是化学实验室常需制取的气体.实验室制取氨气通常有两种方法: