题目内容
16.下列各组粒子属于同位素的是( )| A. | 35Cl和37Cl | B. | 40K和40Ca | C. | O2和O3 | D. | H2O和D2O |
分析 同位素是指质子数相同,中子数不同的同种元素的不同核素,研究对象为核素(原子),据此解答.
解答 解:A.35Cl和37Cl质子数相同,中子数不同,互为同位素,故A正确;
B.40K和40Ca,二者质子数不同,属于不同种元素,故B错误;
C.O2、O3均为单质,互为同素异形体,故C错误;
D.H2O和D2O均为化合物,故D错误;
故选A.
点评 本题考查了同位素的概念,题目难度不大,解题时注意同位素研究对象是原子,同素异形体研究对象是单质,难度不大.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
6.下列离子的电子层结构相同的一组是( )
| A. | O2-、F-、Na+、Mg2+ | B. | Na+、Mg2+、S2-、Cl- | ||
| C. | F-、Cl-、Br-、I- | D. | Na+、Mg2+、K+、Ca2+ |
7.水的电离平衡曲线如图所示,下列说法不正确的是( )
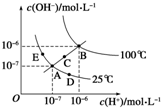

| A. | 图中五点Kw的关系:B>C>A=D=E | |
| B. | 若从A 点到D 点,可采用:温度不变向水中加入少量的酸 | |
| C. | 若从A 点到C 点,可采用:温度不变向水中加入适量的NH4Cl 固体 | |
| D. | 若处在B 点时,将pH=2 的硫酸与pH=10 的KOH 溶液等体积混合后,溶液显中性 |
4.已知同周期X、Y、Z三种元素的最高价氧化物对应水化物酸性由强到弱的顺序为:HXO4>H2YO4>H3ZO4,则下列判断中正确的是( )
| A. | 元素非金属性按X、Y、Z的顺序增强 | |
| B. | 原子半径按X、Y、Z的顺序减小 | |
| C. | 气态氢化物的稳定性按X、Y、Z的顺序增强 | |
| D. | 单质的氧化性按X、Y、Z的顺序减弱 |
11.下列各组离子,在指定条件下,一定能大量共存的是( )
| A. | 水电离产生的c(H+)=1×10-13mol/L的溶液中:K+、Ba2+、Cl-、NO3- | |
| B. | 使紫色石蕊试液变红的溶液中:Fe2+、Mg2+、NO3-、Cl- | |
| C. | 在酸性高锰酸钾溶液中:Na+、NH4+、I-、ClO- | |
| D. | 在FeCl3溶液中:K+、Na+、SO42-、AlO2- |
1.下列物质属于强电解质的是( )
| A. | 碳酸钙 | B. | 盐酸 | C. | 酒精 | D. | 醋酸 |
2.实验设计是一个学生整体综合能力的考察,下列实验不存在问题的是( )
| 实验项目 | 实验目的 | 实验步骤及现象 |
| A | 比较镁和铝的金属性强弱 | 将镁片和铝片用导线连接后,插入NaOH溶液中,镁片上有气泡冒出 |
| B | CO还原Fe2O3得到的黑色固体中是否有Fe3O4 | 黑色固体中加入盐酸溶解后再加入KSCN溶液,溶液不显红色 |
| C | 比较25℃时K(NH3•H2O)与K(HF)电离常数的大小 | 在25℃时,用pH计测定0.1mol/L的NH4F溶液的pH,pH=6.2 |
| D | 检验气体中是否含有乙烯 | 将乙醇与浓硫酸共热制得的气体通入酸性KMnO4溶液中,紫色消失 |
| A. | A | B. | B | C. | C | D. | D |

 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 度小
度小