题目内容
4.已知同周期X、Y、Z三种元素的最高价氧化物对应水化物酸性由强到弱的顺序为:HXO4>H2YO4>H3ZO4,则下列判断中正确的是( )| A. | 元素非金属性按X、Y、Z的顺序增强 | |
| B. | 原子半径按X、Y、Z的顺序减小 | |
| C. | 气态氢化物的稳定性按X、Y、Z的顺序增强 | |
| D. | 单质的氧化性按X、Y、Z的顺序减弱 |
分析 同周期从左向右非金属性增强,由同周期X、Y、Z三种元素的最高价氧化物对应水化物酸性由强到弱的顺序为:HXO4>H2YO4>H3ZO4,可知非金属性X>Y>Z,原子序数为X>Y>Z,然后结合元素周期律来解答.
解答 解:同周期从左向右非金属性增强,由同周期X、Y、Z三种元素的最高价氧化物对应水化物酸性由强到弱的顺序为:HXO4>H2YO4>H3ZO4,可知非金属性X>Y>Z,原子序数为X>Y>Z,
A.元素非金属性按X、Y、Z的顺序减弱,故A错误;
B.同周期原子序数大的原子半径小,则原子半径按X、Y、Z的顺序增大,故B错误;
C.非金属性X>Y>Z,气态氢化物的稳定性按X、Y、Z的顺序减弱,故C错误;
D.非金属性X>Y>Z,单质的氧化性按X、Y、Z的顺序减弱,故D正确;
故选D.
点评 本题考查元素周期律和周期表,为高频考点,把握元素的位置、性质、非金属性的比较方法为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
15.下列化学用语正确的是( )
| A. | HClO的电子式: | B. | 中子数为10的氧原子:${\;}_{8}^{18}$O | ||
| C. | 乙烯的结构简式 CH2CH2 | D. | CH4分子的球棍模型: |
12.下列各组离子能大量共存于同一溶液中,且加入少量NaOH溶液或少量稀硫酸时都能产生白色沉淀的是( )
| A. | Ba2+、Mg2+、NO3-、CO32- | B. | Na+、Ag+、Cl-、Ba2+ | ||
| C. | K+、Ba2+、Cl-、HCO3- | D. | Ba2+、Na+、NO3-、Cl- |
19.百里酚(结构简式为: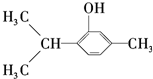 )用于制香料、药物和指示剂等,下列说法正确的是( )
)用于制香料、药物和指示剂等,下列说法正确的是( )
 )用于制香料、药物和指示剂等,下列说法正确的是( )
)用于制香料、药物和指示剂等,下列说法正确的是( )| A. | 百里酚的分子式为C10H16O | |
| B. | 百里酚可与氯化铁发生显色反应 | |
| C. | 百里酚分子中所有碳原子可以在同一平面上 | |
| D. | 百里酚既可与盐酸反应,又可与氢氧化钠溶液反应 |
9.在下列元素中,最高正化合价数值最大的是( )
| A. | Na | B. | P | C. | Cl | D. | F |
16.下列各组粒子属于同位素的是( )
| A. | 35Cl和37Cl | B. | 40K和40Ca | C. | O2和O3 | D. | H2O和D2O |
10.下列离子方程式书写正确的是( )
| A. | 将Ba(OH)2溶液不断加入KAl(SO4)2溶液中反应至沉淀物质的量最大:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ | |
| B. | Cl2通入冷水中:Cl2+H2O═Cl-+ClO-+2H+ | |
| C. | CuSO4溶液跟Ba(OH)2溶液混合:Ba2++SO42-═BaSO4↓ | |
| D. | 漂白粉溶液中通入足量SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
