题目内容
2.实验设计是一个学生整体综合能力的考察,下列实验不存在问题的是( )| 实验项目 | 实验目的 | 实验步骤及现象 |
| A | 比较镁和铝的金属性强弱 | 将镁片和铝片用导线连接后,插入NaOH溶液中,镁片上有气泡冒出 |
| B | CO还原Fe2O3得到的黑色固体中是否有Fe3O4 | 黑色固体中加入盐酸溶解后再加入KSCN溶液,溶液不显红色 |
| C | 比较25℃时K(NH3•H2O)与K(HF)电离常数的大小 | 在25℃时,用pH计测定0.1mol/L的NH4F溶液的pH,pH=6.2 |
| D | 检验气体中是否含有乙烯 | 将乙醇与浓硫酸共热制得的气体通入酸性KMnO4溶液中,紫色消失 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Al与NaOH反应,而Mg不能;
B.黑色固体若为Fe、Fe3O4的混合物,溶于盐酸后溶液中加KSCN溶液不显红色,若只有Fe,现象相同;
C.pH=6.2,可知溶液显酸性,酸的电离程度大;
D.生成的乙烯和挥发的乙醇均使高锰酸钾褪色.
解答 解:A.Al与NaOH反应,而Mg不能,则Al、Mg、NaOH构成的原电池不能说明Mg的金属性强,故A错误;
B.黑色固体若为Fe、Fe3O4的混合物,溶于盐酸后溶液中加KSCN溶液不显红色,若只有Fe,现象相同,不能确定是否含Fe3O4,故B错误;
C.pH=6.2,可知溶液显酸性,酸的电离程度大,则能比较25℃时K(NH3•H2O)与K(HF)电离常数的大小,故C正确;
D.生成的乙烯和挥发的乙醇均使高锰酸钾褪色,则不能利用褪色判断乙烯的生成,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握原电池、电离平衡常数、有机物的性质等为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
15.下列化学用语正确的是( )
| A. | HClO的电子式: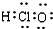 | B. | 中子数为10的氧原子:${\;}_{8}^{18}$O | ||
| C. | 乙烯的结构简式 CH2CH2 | D. | CH4分子的球棍模型: |
16.下列各组粒子属于同位素的是( )
| A. | 35Cl和37Cl | B. | 40K和40Ca | C. | O2和O3 | D. | H2O和D2O |
10.下列离子方程式书写正确的是( )
| A. | 将Ba(OH)2溶液不断加入KAl(SO4)2溶液中反应至沉淀物质的量最大:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ | |
| B. | Cl2通入冷水中:Cl2+H2O═Cl-+ClO-+2H+ | |
| C. | CuSO4溶液跟Ba(OH)2溶液混合:Ba2++SO42-═BaSO4↓ | |
| D. | 漂白粉溶液中通入足量SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |