题目内容
下列有关焓(H)判据和熵(S)判据的叙述正确的是( )
| A、△H>0的反应使体系能量升高,不能自发进行 |
| B、△H<0的反应使体系能量降低,无需加热便能自发进行 |
| C、在与外界隔离的体系中,自发过程将导致熵增大 |
| D、熵增原理说明△S<0过程在任何条件下都不能自发进行 |
考点:焓变和熵变
专题:化学反应中的能量变化
分析:熵变与焓变都与反应能否自发进行有关,但都不是唯一因素,反应能否自发进行应依据△H-T△S是否小于0判断.
解答:
解:A.△H>0不能保证△H-T△S一定小于0,所以反应不一定能自发进行,故A错误;
B.△H<0不能保证△H-T△S一定小于0,所以反应不一定能自发进行,故B错误;
C.与外界隔离的体系没有能量的变化,过程自发应满足△H-T△S<0,所以△S应变大,该过程为熵增过程,故C正确;
D.熵增原理只是说明熵增加有利于反应的自发进行,如果△S<0,△H<0,则在低温下可以使△H-T△S<0,可以自发进行,故D错误;
故选C.
B.△H<0不能保证△H-T△S一定小于0,所以反应不一定能自发进行,故B错误;
C.与外界隔离的体系没有能量的变化,过程自发应满足△H-T△S<0,所以△S应变大,该过程为熵增过程,故C正确;
D.熵增原理只是说明熵增加有利于反应的自发进行,如果△S<0,△H<0,则在低温下可以使△H-T△S<0,可以自发进行,故D错误;
故选C.
点评:本题考查了反应能否自发进行的判据,题目难度不大,把握△H-T△S<0是反应自发进行的唯一判据是解题的关键.

练习册系列答案
相关题目
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是( )

| A、CO2(g)+H2(g)?CO(g)+H2O(g);△H>0 |
| B、CO2(g)+2NH3(g)?CO(NH2)2(s)+H2O(g);△H<0 |
| C、CH3CH2OH(g)?CH2=CH2(g)+H2O(g);△H>0 |
| D、2C6H5CH2CH3(g)+O2(g)?2C6H5CH═CH2(g)+2H2O(g);△H<0 |
20mL 1mol/L NaCl溶液和40mL 0.5mol/L MgCl2溶液混合之后(体积的变化忽略不计),混合液中Cl-的物质的量浓度为( )
| A、0.5 mol/L |
| B、0.6 mol/L |
| C、1 mol/L |
| D、2 mol/L |
下列有关实验的叙述正确的是( )
| A、用分液的方法分离水和酒精的混合物 |
| B、容量瓶用水洗净后,可不经干燥直接用于配制溶液 |
| C、配制1L0.1mol/L的NaCl溶液时可用托盘天平称量5.85gNaCl固体 |
| D、用滴管滴加液体时,为防止液滴溅出,滴管紧贴试管内壁 |
下列结论错误的是( )
①微粒半径:K+>Al3+>S2->C1-
②氢化物的稳定性:HF>HC1>H2S>PH3>SiH4
③离子的还原性:S2->C1->Br->I-
④氧化性:C12>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO4
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K.
①微粒半径:K+>Al3+>S2->C1-
②氢化物的稳定性:HF>HC1>H2S>PH3>SiH4
③离子的还原性:S2->C1->Br->I-
④氧化性:C12>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO4
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K.
| A、只有① | B、①③ |
| C、②④⑤ | D、①③⑤ |
下列变化中,需要加入氧化剂才能实现的是( )
| A、HCl→H2 |
| B、FeO→Fe2+ |
| C、SO2→SO3 |
| D、CO32-→CO2 |
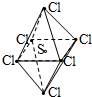 SCl6是一种无色的很稳定的物质,可用于灭火.SCl6的分子结构如图所示,呈正八面体型.如果氯元素有两种稳定的同位素,则SCl6的不同的分子种数为( )
SCl6是一种无色的很稳定的物质,可用于灭火.SCl6的分子结构如图所示,呈正八面体型.如果氯元素有两种稳定的同位素,则SCl6的不同的分子种数为( )