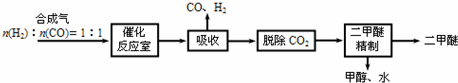
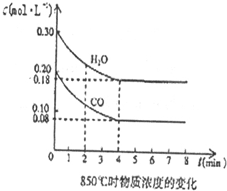
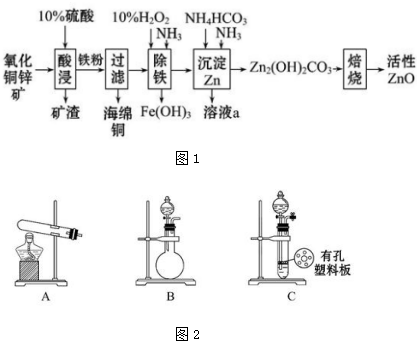
题目内容
15.下列条件的改变肯定不会导致化学平衡移动的是( )| A. | 催化剂 | B. | 浓度 | C. | 压强 | D. | 温度 |
分析 A.催化剂对平衡移动无影响;
B.对反应前后体积不变的反应,缩小体积,浓度均增大,但平衡不移动;
C.对反应前后体积不变的反应,增大压强,平衡不移动;
D.反应中一定为吸热或放热反应,升高温度平衡向吸热的方向移动.
解答 解:A.改变催化剂,平衡一定不发生移动,故A不选;
B.对反应前后体积不变的反应,缩小或增大体积改变浓度,平衡不移动,故B不选;
C.对反应前后体积不变的反应,改变压强,平衡不移动,故C不选;
D.反应一定伴随能量变化,则改变温度,平衡一定发生移动,故D选;
故选D.
点评 本题考查化学平衡移动,为高频考点,把握温度、浓度、压强对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意分析反应方程式的特点,题目难度不大.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目
6.酸碱中和滴定是中学化学常见实验.某学校化学课外小组用标准液盐酸滴定未知浓度的氨水溶液,试回答下列问题.
(1)选用的指示剂是甲基橙,滴定终点的颜色变化为甲基橙.
(2)某学生根据3次实验分别记录有关数据如表:
依据如表数据列式并计算该NH3•H2O溶液的物质的量浓度0.1044mol/L.
(3)下列实验操作对滴定结果产生什么影响(填“偏高”、“偏低”或“无影响”)?
A.观察酸式滴定管液面时,开始仰视,滴定终点平视,则滴定结果偏低.
B.若将锥形瓶用待测液润洗,然后再加入25.00mL待测液,则滴定结果偏高.
C.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失偏高
D.锥形瓶内溶液颜色出现变色,立即记下滴定管内液面所在刻度偏低
(4)若用0.10mol•L-1的盐酸滴定0.10mol•L-1的氨水,滴定过程中可能出现的结果是ABD
A.c(NH4+)>c(Cl-),c(OH-)>c(H+) B.c(NH4+)=c(Cl-),c(OH-)=c(H+)
C.c(Cl-)>c(NH4+),c(OH-)>c(H+) D.c(Cl-)>c(NH4+),c(H+)>c(OH-)
(5)若25℃时,将a mol/L的氨水与0.10mol/L的盐酸等体积混合,溶液中
c(NH4+ )=c(Cl-).则溶液显中性(填“酸”、“碱”或“中”);用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-8}}{a-0.1}$.
(1)选用的指示剂是甲基橙,滴定终点的颜色变化为甲基橙.
(2)某学生根据3次实验分别记录有关数据如表:
| 滴定次数 | 待测氨水溶液的体积/mL | 0.10mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
(3)下列实验操作对滴定结果产生什么影响(填“偏高”、“偏低”或“无影响”)?
A.观察酸式滴定管液面时,开始仰视,滴定终点平视,则滴定结果偏低.
B.若将锥形瓶用待测液润洗,然后再加入25.00mL待测液,则滴定结果偏高.
C.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失偏高
D.锥形瓶内溶液颜色出现变色,立即记下滴定管内液面所在刻度偏低
(4)若用0.10mol•L-1的盐酸滴定0.10mol•L-1的氨水,滴定过程中可能出现的结果是ABD
A.c(NH4+)>c(Cl-),c(OH-)>c(H+) B.c(NH4+)=c(Cl-),c(OH-)=c(H+)
C.c(Cl-)>c(NH4+),c(OH-)>c(H+) D.c(Cl-)>c(NH4+),c(H+)>c(OH-)
(5)若25℃时,将a mol/L的氨水与0.10mol/L的盐酸等体积混合,溶液中
c(NH4+ )=c(Cl-).则溶液显中性(填“酸”、“碱”或“中”);用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-8}}{a-0.1}$.
10.对于平衡体系:aA(g)+bB(g)?cC(g)+dD(g)△H<0,下列判断中正确的是( )
| A. | 若a+b<c+d,增大压强,则平衡向左移动 | |
| B. | 若从正反应开始,起始时A、B的物质的量之比为a:b,则平衡时A、B的转化率之比为a:b | |
| C. | 若a+b=c+d,在平衡体系中共有气体m mol,再向其中充入n mol B,则达到平衡时气体总物质的量小于(m+n)mol | |
| D. | 若a+b=c+d,则对于体积不变的容器,升高温度,平衡向左移动,容器中气体压强不变 |
20.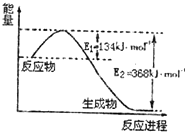 氮是地球上含量较丰富的一种元素,氮及其化合物在工农业生产、日常生活中有着重要作用.
氮是地球上含量较丰富的一种元素,氮及其化合物在工农业生产、日常生活中有着重要作用.
(1)图是1mol NO2(g)和1mol CO(g)反应生成CO2(g)和NO(g)过程中能量变化示意图,请写出NO2和CO反应的热化学方程式NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1.
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0
其化学平衡常数K与温度t的关系如表:
完成下列问题:
①比较K1、K2的大小:K1>K2(填“>”、“=”或“<”).
②判断该反应达到化学平衡状态的依据是AC(填序号).
A.2vH2(正)=3vNH3(逆)
B.3vNH3(正)=2vH2(正)
C.容器内压强保持不变
D.混合气体的密度保持不变.
 氮是地球上含量较丰富的一种元素,氮及其化合物在工农业生产、日常生活中有着重要作用.
氮是地球上含量较丰富的一种元素,氮及其化合物在工农业生产、日常生活中有着重要作用.(1)图是1mol NO2(g)和1mol CO(g)反应生成CO2(g)和NO(g)过程中能量变化示意图,请写出NO2和CO反应的热化学方程式NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1.
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0
其化学平衡常数K与温度t的关系如表:
| t/℃ | 25 | 125 | 225 | … |
| K/(mol•L-1)-2 | 4.1×106 | K1 | K2 | … |
①比较K1、K2的大小:K1>K2(填“>”、“=”或“<”).
②判断该反应达到化学平衡状态的依据是AC(填序号).
A.2vH2(正)=3vNH3(逆)
B.3vNH3(正)=2vH2(正)
C.容器内压强保持不变
D.混合气体的密度保持不变.