��Ŀ����
�������ֿ���������A��B��C��D��E���������������������ӻ�����ͬ���ֱ�������������K+��Fe3+��Cu2+��Ba2+��A13+������������Cl-��OH-��NO3-��CO32-��X�е�һ�֣�
��1��ijͬѧͨ���ȽϷ�������Ϊ�������Ϳ��ж����������п϶��е����������� �� ��
��2������C�к�������X��Ϊ��ȷ��X���ֽ���1���е��������ʼ�ΪA��B����C��A����Һ���ʱ������ɫ��������ó����е�������ϡHNO3�����������ܽ⣬ʣ���ɫ���壮��XΪ ������ĸ����
A��Br- B��SO42-C��CH3COO-D��HCO3-
��3����19.2g CuͶ��װ������D��Һ���Թ��У�Cu���ܽ⣬�ٵμ�ϡH2SO4��Cu���ܽ⣬�ܿڸ����к���ɫ������֣�д��Cu�ܽ�����ӷ���ʽ ����Ҫ��Cu��ȫ�ܽ⣬����Ӧ����H2SO4�����ʵ����� ��
��4�����ö��Ե缫���C��D�Ļ����Һ�������ʵ����ʵ�����Ϊ0.1mol��ͨ�����������������1.12Lʱ�������������������Ϊ L�������������Ϊ��״�����Ҳ�����������ˮ�е��ܽ⣩
��5����E��Һ���ɺ����ù������գ����յõ��Ĺ���ɷ��ǣ��ѧʽ�� ��
��1��ijͬѧͨ���ȽϷ�������Ϊ�������Ϳ��ж����������п϶��е�����������
��2������C�к�������X��Ϊ��ȷ��X���ֽ���1���е��������ʼ�ΪA��B����C��A����Һ���ʱ������ɫ��������ó����е�������ϡHNO3�����������ܽ⣬ʣ���ɫ���壮��XΪ
A��Br- B��SO42-C��CH3COO-D��HCO3-
��3����19.2g CuͶ��װ������D��Һ���Թ��У�Cu���ܽ⣬�ٵμ�ϡH2SO4��Cu���ܽ⣬�ܿڸ����к���ɫ������֣�д��Cu�ܽ�����ӷ���ʽ
��4�����ö��Ե缫���C��D�Ļ����Һ�������ʵ����ʵ�����Ϊ0.1mol��ͨ�����������������1.12Lʱ�������������������Ϊ
��5����E��Һ���ɺ����ù������գ����յõ��Ĺ���ɷ��ǣ��ѧʽ��
���㣺���ӹ�������,�������ӵļ��鷽��,���ԭ��
ר�⣺���ӷ�Ӧר��,�绯ѧר��
����������������Al3+��Cu2+��Ba2+��Fe3+��������CO32-���棬����CO32-ֻ����K+��ϳ�Na2CO3���ڣ�����Al3+��Cu2+��Fe3+��������OH-���棬����OH-ֻ����Ba2+��ϳ�Ba��OH��2���ڣ�
�ɣ�2����֪����C��A����Һ���ʱ������ɫ��������ó����е�������ϡHNO3�����������ܽ⣬ʣ���ɫ���壬���ѵó�BΪK2CO3��AΪBa��OH��2��C����Cu2+������C��A��Ӧ�����İ�ɫ����������ϡHNO3����CΪCuSO4������������D�ܺ�ͭ��Ӧ��˵��D�к�����������ӣ���E�к���Cl-��
��϶�Ӧ���ʵ������Լ���ĿҪ��ɽ����⣮
�ɣ�2����֪����C��A����Һ���ʱ������ɫ��������ó����е�������ϡHNO3�����������ܽ⣬ʣ���ɫ���壬���ѵó�BΪK2CO3��AΪBa��OH��2��C����Cu2+������C��A��Ӧ�����İ�ɫ����������ϡHNO3����CΪCuSO4������������D�ܺ�ͭ��Ӧ��˵��D�к�����������ӣ���E�к���Cl-��
��϶�Ӧ���ʵ������Լ���ĿҪ��ɽ����⣮
���
�⣺����������Al3+��Cu2+��Ba2+��Fe3+��������CO32-���棬����CO32-ֻ����K+��ϳ�Na2CO3���ڣ�����Al3+��Cu2+��Fe3+��������OH-���棬����OH-ֻ����Ba2+��ϳ�Ba��OH��2���ڣ�
�ɣ�2����֪����C��A����Һ���ʱ������ɫ��������ó����е�������ϡHNO3�����������ܽ⣬ʣ���ɫ���壬���ѵó�BΪK2CO3��AΪBa��OH��2��C����Cu2+������C��A��Ӧ�����İ�ɫ����������ϡHNO3����CΪCuSO4������������D�ܺ�ͭ��Ӧ��˵��D�к�����������ӣ���E�к���Cl-��
��1��CO32-��Al3+��Cu2+��Ba2+��Fe3+���ܴ������棬OH-��Al3+��Cu2+��Fe3+���ܴ������棬�����������������ӻ�����ͬ�����Զ�Ӧ������ӦΪK2CO3��Ba��OH��2��
�ʴ�Ϊ��K2CO3�� Ba��OH��2��
��2����C��A����Һ���ʱ������ɫ��������ó����е�������ϡHNO3�����������ܽ⣬ʣ���ɫ���壬���ѵó�BΪK2CO3��AΪBa��OH��2��C����Cu2+������C��A��Ӧ�����İ�ɫ����������ϡHNO3����CΪCuSO4��HCO3-
��Cu2+���ܹ��棬CH3COO-��Br-���������ɱ��γ�������Xֻ��ΪSO42-��
�ʴ�Ϊ��B��
��3�����������ƶϿ�֪D�к���NO3-����֪��19.2gCuͶ��װ������D��Һ���Թ��У�Cu���ܽ⣻�ٵμ�ϡH2SO4��Cu���ܽ⣬�����ķ�ӦΪ3Cu+8H++2NO3-�T3Cu2++2NO��+4H2O
��n��Cu��=mM=
=0.3mol��
�з��̿�֪
=
��
����n��H+��=0.8mol��
����n��H2SO4��=12n��H+��=0.4mol��
�ʴ�Ϊ��3Cu+8H++2NO3-�T3Cu2++2NO��+4H2O��0.4mol��
��4��CΪCuSO4��D�к�����������ӣ��������Һ��⣬���������������ӷŵ磬������ͭ���ӷŵ�������ӷŵ磬������ͭ���ӷŵ�ת�Ƶ��ӵ����ʵ���=0.1mol��2=0.2mol����������ת�Ƶ��ӵ����ʵ���=
��2=0.1mol��������·��ת�Ƶ�����ȣ�����������ת�Ƶ��ӵ����ʵ���Ϊ0.2mol+0.1mol=0.3mol�������������������=
��22.4L/mol=1.68L��
�ʴ�Ϊ��1.68��
��5�����D������������4����ͭ��û�м�ϡ����֮ǰ���ܽ⣬ʵ����ͭû���ܽ⣬��D��Al��NO3��3������E��FeCl3�����������Ȼ�����Һʱ���Ȼ���ˮ�⣬�����¶ȴٽ�HCl�ӷ���������ʱ�õ��Ĺ�����Fe��OH��3��������������ʱ�����������ֽ�õ�Fe2O3��
�ʴ�Ϊ��Fe2O3��
�ɣ�2����֪����C��A����Һ���ʱ������ɫ��������ó����е�������ϡHNO3�����������ܽ⣬ʣ���ɫ���壬���ѵó�BΪK2CO3��AΪBa��OH��2��C����Cu2+������C��A��Ӧ�����İ�ɫ����������ϡHNO3����CΪCuSO4������������D�ܺ�ͭ��Ӧ��˵��D�к�����������ӣ���E�к���Cl-��
��1��CO32-��Al3+��Cu2+��Ba2+��Fe3+���ܴ������棬OH-��Al3+��Cu2+��Fe3+���ܴ������棬�����������������ӻ�����ͬ�����Զ�Ӧ������ӦΪK2CO3��Ba��OH��2��
�ʴ�Ϊ��K2CO3�� Ba��OH��2��
��2����C��A����Һ���ʱ������ɫ��������ó����е�������ϡHNO3�����������ܽ⣬ʣ���ɫ���壬���ѵó�BΪK2CO3��AΪBa��OH��2��C����Cu2+������C��A��Ӧ�����İ�ɫ����������ϡHNO3����CΪCuSO4��HCO3-
��Cu2+���ܹ��棬CH3COO-��Br-���������ɱ��γ�������Xֻ��ΪSO42-��
�ʴ�Ϊ��B��
��3�����������ƶϿ�֪D�к���NO3-����֪��19.2gCuͶ��װ������D��Һ���Թ��У�Cu���ܽ⣻�ٵμ�ϡH2SO4��Cu���ܽ⣬�����ķ�ӦΪ3Cu+8H++2NO3-�T3Cu2++2NO��+4H2O
��n��Cu��=mM=
| 19.2g |
| 64g/mol |
�з��̿�֪
| 3 |
| 8 |
| 0.3mol |
| n(H+) |
����n��H+��=0.8mol��
����n��H2SO4��=12n��H+��=0.4mol��
�ʴ�Ϊ��3Cu+8H++2NO3-�T3Cu2++2NO��+4H2O��0.4mol��
��4��CΪCuSO4��D�к�����������ӣ��������Һ��⣬���������������ӷŵ磬������ͭ���ӷŵ�������ӷŵ磬������ͭ���ӷŵ�ת�Ƶ��ӵ����ʵ���=0.1mol��2=0.2mol����������ת�Ƶ��ӵ����ʵ���=
| 1.12L |
| 22.4L/mol |
| 0.3mol |
| 4 |
�ʴ�Ϊ��1.68��
��5�����D������������4����ͭ��û�м�ϡ����֮ǰ���ܽ⣬ʵ����ͭû���ܽ⣬��D��Al��NO3��3������E��FeCl3�����������Ȼ�����Һʱ���Ȼ���ˮ�⣬�����¶ȴٽ�HCl�ӷ���������ʱ�õ��Ĺ�����Fe��OH��3��������������ʱ�����������ֽ�õ�Fe2O3��
�ʴ�Ϊ��Fe2O3��
���������⿼�������ӹ��棬�漰���ԭ��������ˮ�⡢���ʵ����ļ����֪ʶ�㣬���������Ϣ�ƶ����ʣ��ٽ�����ӷŵ�˳������ˮ���ص㼰���ʼ�ķ�Ӧ���������ע�⣨4���е��ʱ��ͭ�����ȷŵ硢�����Ӻ�ŵ磬Ϊ�״��㣮

��ϰ��ϵ�д�
 ״Ԫ��ȫ��ͻ�Ƶ�����ϵ�д�
״Ԫ��ȫ��ͻ�Ƶ�����ϵ�д� ֱͨ������У�ܲ��¿�ֱͨ��Уϵ�д�
ֱͨ������У�ܲ��¿�ֱͨ��Уϵ�д�
�����Ŀ
ij�����Ħ������ΪM g?mol-1��NA��ʾ�����ӵ���������һ�����¶Ⱥ�ѹǿ�£����ΪV L�ĸ����������еķ�����Ϊx����
��ʾ���ǣ�������
| Mx |
| VNA |
| A����������ܶȣ���g/LΪ��λ�� |
| B��VL���������������g��� |
| C��1mol��������������L��� |
| D��1L�������������ķ����� |
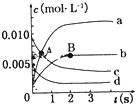 ��2L�ܱ������У�800��ʱ��Ӧ2NO��g��+O2��g��?2NO2��g����ϵ�У�n��NO����ʱ��ı仯�����
��2L�ܱ������У�800��ʱ��Ӧ2NO��g��+O2��g��?2NO2��g����ϵ�У�n��NO����ʱ��ı仯�����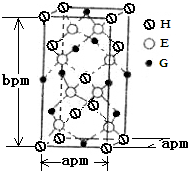 A��B��D��E��G��H����ǰ�����ڵ�Ԫ�أ�������ǰ�����ڵĻ�̬ԭ����A��δ�ɶԵ�����ࣻB��̬ԭ�ӵ�L���Ӳ��p�ܼ�����һ���չ����D �Ļ�̬ԭ�ӵ�2p�������1�����ӵ������������������ӵ����������෴��E�Ļ�̬ԭ��M����6���˶�״̬��ͬ�ĵ��ӣ� G�����ڱ���λ�ڵ�8�У�H��ԭ��������G��3��������Ϣ�ش��������⣺
A��B��D��E��G��H����ǰ�����ڵ�Ԫ�أ�������ǰ�����ڵĻ�̬ԭ����A��δ�ɶԵ�����ࣻB��̬ԭ�ӵ�L���Ӳ��p�ܼ�����һ���չ����D �Ļ�̬ԭ�ӵ�2p�������1�����ӵ������������������ӵ����������෴��E�Ļ�̬ԭ��M����6���˶�״̬��ͬ�ĵ��ӣ� G�����ڱ���λ�ڵ�8�У�H��ԭ��������G��3��������Ϣ�ش��������⣺