题目内容
25℃时,下列说法中,不正确的是( )
| A、将体积均为100mL、浓度均为0.1mol/L的Ba(OH)2溶液与Na2SO4溶液混合,若混合后溶液的体积为100mL,则所得溶液的pH=13 |
| B、将等体积等浓度的醋酸与CH3COONa溶液混合,所得溶液中:c(Na+)+c(H+)═c(CH3COO-)+c(OH-) |
| C、将等体积等浓度的Na2CO3溶液与NaHCO3溶液混合,所得溶液中:2c(Na+)═c(CO32-)+c(HCO3-)+c(H2CO3) |
| D、将等体积等浓度的Na2CO3溶液与NaOH溶液混合,所得溶液中:c(Na+)>c(OH-)>c(CO32-)>c(H+) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A.二者反应生成硫酸钡和NaOH,实际上氢氧根离子没有参加反应,只是溶液体积增大一倍,则混合溶液中c(OH-)=0.1mol/L,c(H+)=
,据此计算溶液的pH;
B.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
C.任何电解质溶液在都存在物料守恒,根据物料守恒判断;
D.溶液中的溶质为碳酸钠和NaOH,溶液呈碱性,碳酸根离子水解生成氢氧根离子,但水解程度较小.
| 10-14 |
| c(OH-) |
B.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
C.任何电解质溶液在都存在物料守恒,根据物料守恒判断;
D.溶液中的溶质为碳酸钠和NaOH,溶液呈碱性,碳酸根离子水解生成氢氧根离子,但水解程度较小.
解答:
解:A.二者反应生成硫酸钡和NaOH,实际上氢氧根离子没有参加反应,只是溶液体积增大一倍,则混合溶液中c(OH-)=0.1mol/L,c(H+)=
=10-13 mol/L,溶液的pH=13,故A正确;
B.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)═c(CH3COO-)+c(OH-),故B正确;
C.任何电解质溶液在都存在物料守恒,根据物料守恒得2c(Na+)═3c(CO32-)+3c(HCO3-)+3c(H2CO3),故C错误;
D.溶液中的溶质为碳酸钠和NaOH,溶液呈碱性,碳酸根离子水解生成氢氧根离子,但水解程度较小,所以离子浓度大小顺序是c(Na+)>c(OH-)>c(CO32-)>c(H+),故D正确;
故选C.
| 10-14 |
| c(OH-) |
B.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)═c(CH3COO-)+c(OH-),故B正确;
C.任何电解质溶液在都存在物料守恒,根据物料守恒得2c(Na+)═3c(CO32-)+3c(HCO3-)+3c(H2CO3),故C错误;
D.溶液中的溶质为碳酸钠和NaOH,溶液呈碱性,碳酸根离子水解生成氢氧根离子,但水解程度较小,所以离子浓度大小顺序是c(Na+)>c(OH-)>c(CO32-)>c(H+),故D正确;
故选C.
点评:本题考查离子浓度大小比较,明确溶液中的溶质及溶液酸碱性是解本题关键,再结合物料守恒、电荷守恒判断,易错选项是C,注意钠离子和含有C元素微粒的关系,为易错点.

练习册系列答案
相关题目
1994年3月21日,106号元素被美国化学会命名为西博格(seaborgium),该元素是( )
| A、第ⅥB族元素 |
| B、第ⅤA族元素 |
| C、镧系元素 |
| D、锕系元素 |
光纤通讯是一种现代化的通讯手段,光导纤维的成分是( )
| A、Na2SiO3 |
| B、Si |
| C、SiO2 |
| D、CaCO3 |
X元素的气态单质X2 10mL与Y元素的气态单质Y2 20mL均完全反应后生成气态物Z 20mL(气体体积均在相同条件下测得).气态物Z的分子式为( )
| A、XY |
| B、X2Y |
| C、XY2 |
| D、XY3 |
N2O5是一种新型绿色硝化剂,其性质和制备受到人们的关注.已知一定条件下会发生反应:2N2O5(g)?4NO2(g)+O2(g)△H>0,平衡常数为K.下列叙述正确的是( )
| A、上述反应的平衡常数随温度升高而增大 |
| B、上述反应达到平衡后,只增大氧气浓度,因为K值变大了,所以平衡将向左移动 |
C、N2O5与苯发生硝化反应除了生成硝基苯(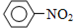 ),还有氧气生成 ),还有氧气生成 |
| D、以N2O4等为原料采用电化学方法可以合成N2O5,该合成应避免碱性环境 |
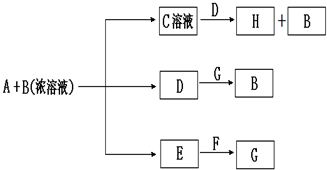
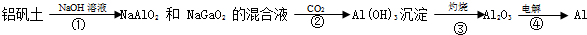
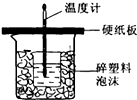 I.已知中和热是指酸跟碱发生中和反应生成lmol H2O时的反应热.
I.已知中和热是指酸跟碱发生中和反应生成lmol H2O时的反应热.