题目内容
化工厂常用氨水检验管道是否漏气,其反应式为3Cl2+8NH3=6NH4Cl+N2,当有160.5克NH4Cl产生时,被氧化的氨气是多少克?反应的氯气的体积为多少(标准状况下)?
考点:氧化还原反应的计算
专题:
分析:3Cl2+8NH3═6NH4Cl+N2中,Cl元素的化合价降低,N元素的化合价升高,结合元素化合价的变化以及反应的方程式解答.
解答:
解:n(NH4Cl)=
=3mol,
3Cl2+8NH3=6NH4Cl+N2,被氧化NH3
3 8 6 2
x 3 y
x=1.5mol,
y=1mol,
被氧化的氨气的质量为1mol×17g/mol=17g,
反应的氯气的体积为1.5mol×22.4L/mol=33.6L,
答:被氧化的氨气是17克;反应的氯气的体积为33.6升.
| 160.5g |
| 53.5g/mol |
3Cl2+8NH3=6NH4Cl+N2,被氧化NH3
3 8 6 2
x 3 y
x=1.5mol,
y=1mol,
被氧化的氨气的质量为1mol×17g/mol=17g,
反应的氯气的体积为1.5mol×22.4L/mol=33.6L,
答:被氧化的氨气是17克;反应的氯气的体积为33.6升.
点评:本题考查氧化还原反应计算,为高考常考考点,侧重计算能力的考查,明确反应中元素的化合价变化结合方程式解答该题,题目难度不大.

练习册系列答案
相关题目
在含有Ba2+、Ca2+、Ag+的酸性溶液中,可能存在的阴离子是( )
| A、SO42- |
| B、NO3- |
| C、Cl- |
| D、CO32- |
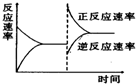 如图是关于反应A2(g)+3B2(g)=2C(g)(正反应为放热反应)的平衡移动图形,影响平衡移动的原因是( )
如图是关于反应A2(g)+3B2(g)=2C(g)(正反应为放热反应)的平衡移动图形,影响平衡移动的原因是( )| A、升高温度,同时加压 |
| B、降低温度,同时减压 |
| C、增大反应物浓度,同时使用催化剂 |
| D、增大反应物浓度,同时减小生成物浓度 |
氧化还原反应的实质是( )
| A、化合价的升降 |
| B、分子中各原子重新组合 |
| C、电子的得失或共用电子对的偏移 |
| D、氧原子的得失 |
在200g浓度为18mol/L、密度为ρ(g/cm3)的浓硫酸中加入一定量的水稀释成9mol/L的硫酸,如果水的密度为1g/cm3则加入水的体积( )
| A、小于200mL |
| B、等于200mL |
| C、大于200mL |
| D、不能确定 |