题目内容
6.用标准的氢氧化钠溶液(浓度为0.1212mol/L)测定未知浓度的20.00mL盐酸溶液.(1)滴定时一般可用酚酞做指示剂,当溶液由无色变成浅红色,且半分钟不褪色,则达到滴定终点.
(2)盛放标准氢氧化钠溶液滴定管的初读数为0.10mL,末读数为20.20mL,则滴定中,消耗标准氢氧化钠溶液的体积为20.10mL,则该盐酸的浓度为0.1218mol/L.
(3)装标准氢氧化钠溶液的滴定管用蒸馏水润洗后,未用标准液润洗导致测定结果(填“偏小”、“偏大”或“无影响”)偏大.
分析 (1)强碱滴定强酸,反应后呈中性,可用酚酞为指示剂,滴定终点,溶液颜色由无色变为浅红色;
(2)氢氧化钠溶液的体积为20.20mL-0.10mL=20.10mL,酸碱恰好完全反应,满足c(酸)V(酸)=c(碱)V(碱),以此计算;
(3)装标准氢氧化钠溶液的滴定管用蒸馏水润洗后,未用标准液润洗,则标准液的浓度偏小.
解答 解:(1)强碱滴定强酸,反应后呈中性,可用酚酞为指示剂,滴定终点,溶液颜色由无色变为浅红色,如满足半分钟不褪色,可说明达到滴定终点,
故答案为:酚酞;无;浅红;半分钟不褪色;
(2)氢氧化钠溶液的体积为20.20mL-0.10mL=20.10mL,酸碱恰好完全反应,满足c(酸)V(酸)=c(碱)V(碱),则该盐酸的浓度为$\frac{20.12×0.1212}{20.00}$mol/L=0.1218mol/L,
故答案为:20.10;0.1218;
(3)装标准氢氧化钠溶液的滴定管用蒸馏水润洗后,未用标准液润洗,则标准液的浓度偏小,所用标准液的体积偏大,则测定浓度偏大,
故答案为:偏大.
点评 本题考查中和滴定,为高频考点,把握中和滴定操作及误差分析为解答的关键,侧重分析与应用能力的考查,注意误差分析为解答的难点,题目难度不大.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
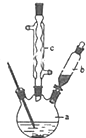
16.己二酸是合成尼龙-66的主要原料之一.实验室合成己二酸的原理、有关数据及装置示意图为: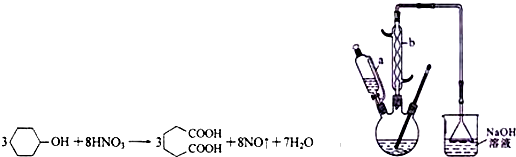
实验步骤如下:
Ⅰ.在三口烧瓶中加入16mL50%的硝酸(密度为1.31g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4mL环己醇.
Ⅱ.水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色
气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间.Ⅲ.当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止.
Ⅳ.趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤、干燥、称重.
请回答下列问题:
(1)装置中仪器b的名称为球形冷凝管(或冷凝管),使用时要从下口(填“上口”或“下口”)通入冷水;滴液漏斗的细支管a的作用是平衡滴液漏斗与三口烧瓶内的气压,使环己醇能够顺利流下.
(2)本实验所用50%的硝酸的物质的量浓度为10.4mol/L;NaOH溶液的作用是吸收NO2,防止污染空气.
(3)向三口烧瓶中滴加环己醇时,反应温度迅速上升,为使反应温度不致过高,必要时可采取的措施是将三口烧瓶置于冷水浴中.
(4)为了除去可能的杂质和减少产品损失,可依次用冷水和苯洗涤晶体.
| 物质 | 密度(20℃) | 熔点 | 沸点 | 溶解性 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度为3.6g,可混溶于乙醇、苯 |
| 己二酸 | 1.360g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇、不溶于苯 |
Ⅰ.在三口烧瓶中加入16mL50%的硝酸(密度为1.31g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4mL环己醇.
Ⅱ.水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色
气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间.Ⅲ.当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止.
Ⅳ.趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤、干燥、称重.
请回答下列问题:
(1)装置中仪器b的名称为球形冷凝管(或冷凝管),使用时要从下口(填“上口”或“下口”)通入冷水;滴液漏斗的细支管a的作用是平衡滴液漏斗与三口烧瓶内的气压,使环己醇能够顺利流下.
(2)本实验所用50%的硝酸的物质的量浓度为10.4mol/L;NaOH溶液的作用是吸收NO2,防止污染空气.
(3)向三口烧瓶中滴加环己醇时,反应温度迅速上升,为使反应温度不致过高,必要时可采取的措施是将三口烧瓶置于冷水浴中.
(4)为了除去可能的杂质和减少产品损失,可依次用冷水和苯洗涤晶体.
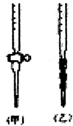
1.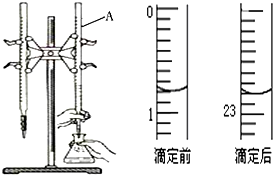 图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:
图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:
(1)仪器A的名称是酸式滴定管;
(2)盐酸的体积读数:
滴定前读数为0.80mL,
滴定后读数为22.80mL.
(3)某实验小组同学的三次实验的实验数据如表所示.根据表中数据计算出的待测NaOH溶液的平均浓度是0.1100mol/L.(保留四位有效数字)
(4)滴定操作可分解为如下几步(所用的仪器刚用蒸馏水洗净):
A.用碱式滴定管向锥形瓶里注入20.00mL待测NaOH溶液,并加入2~3滴酚酞;
B.用标准溶液润洗酸式滴定管2~3次;
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
D.取标准HCl溶液注入酸式滴定管至刻度0以上2~3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准HCl溶液滴定至终点并记下滴定管液面的刻度.
正确操作步骤的顺序是BDCEAF(用序号字母填写)
(5)判断到达滴定终点的实验现象是当溶液颜色由粉红色变为无色,且半分钟内不变色.
(6)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
①如果上述B步骤省略,对测定结果的影响是偏高.
②取待测液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失.偏低
③若滴定前锥形瓶未用待测液润洗,对测定结果的影响是无影响;
④标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是偏低.
 图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:
图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:(1)仪器A的名称是酸式滴定管;
(2)盐酸的体积读数:
滴定前读数为0.80mL,
滴定后读数为22.80mL.
(3)某实验小组同学的三次实验的实验数据如表所示.根据表中数据计算出的待测NaOH溶液的平均浓度是0.1100mol/L.(保留四位有效数字)
| 实验 编号 | 待测NaOH溶液的体积(mL) | 滴定前盐酸的 体积读数(mL) | 滴定后盐酸的 体积读数(mL) |
| 1 | 20.00 | 1.20 | 23.22 |
| 2 | 20.00 | 2.21 | 24.21 |
| 3 | 20.00 | 1.50 | 23.48 |
A.用碱式滴定管向锥形瓶里注入20.00mL待测NaOH溶液,并加入2~3滴酚酞;
B.用标准溶液润洗酸式滴定管2~3次;
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
D.取标准HCl溶液注入酸式滴定管至刻度0以上2~3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准HCl溶液滴定至终点并记下滴定管液面的刻度.
正确操作步骤的顺序是BDCEAF(用序号字母填写)
(5)判断到达滴定终点的实验现象是当溶液颜色由粉红色变为无色,且半分钟内不变色.
(6)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
①如果上述B步骤省略,对测定结果的影响是偏高.
②取待测液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失.偏低
③若滴定前锥形瓶未用待测液润洗,对测定结果的影响是无影响;
④标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是偏低.
18.某同学用标准NaOH溶液来测定未知浓度的盐酸的浓度:
(1)配制250mL 0.5mol/L的NaOH溶液所需的玻璃仪器为烧杯、玻璃棒、250ml容量瓶、胶头滴管.
(2)用滴定管准确量取20.00mL未知浓度的盐酸于锥形瓶中,加入酚酞作指示剂,用NaOH溶液滴定到终点.
该同学进行了三次实验,实验数据如表:
滴定中误差较大的是第1 次实验,造成这种误差的可能原因是bcg(填选项编号)
a、在盛装未知浓度的盐酸之前锥形瓶里面有少量蒸馏水,未烘干
b、滴定管在盛装标准NaOH溶液前未润洗
c、滴定开始前盛装标准NaOH溶液的滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡
d、滴定开始前盛装标准NaOH溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
e、滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
f、达到滴定终点时,俯视溶液凹液面最低点读数
g、滴定到终点时,溶液颜色由无色变到了红色
(3)该同学所测得盐酸的物质的量浓度为0.425mol/L(结果保留三位小数).
(1)配制250mL 0.5mol/L的NaOH溶液所需的玻璃仪器为烧杯、玻璃棒、250ml容量瓶、胶头滴管.
(2)用滴定管准确量取20.00mL未知浓度的盐酸于锥形瓶中,加入酚酞作指示剂,用NaOH溶液滴定到终点.
该同学进行了三次实验,实验数据如表:
| 实验编号 | 盐酸的体积(mL) | 标准NaOH溶液的体积(mL) |
| 1 | 20.00 | 18.20 |
| 2 | 17.10 | |
| 3 | 16.90 |
a、在盛装未知浓度的盐酸之前锥形瓶里面有少量蒸馏水,未烘干
b、滴定管在盛装标准NaOH溶液前未润洗
c、滴定开始前盛装标准NaOH溶液的滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡
d、滴定开始前盛装标准NaOH溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
e、滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
f、达到滴定终点时,俯视溶液凹液面最低点读数
g、滴定到终点时,溶液颜色由无色变到了红色
(3)该同学所测得盐酸的物质的量浓度为0.425mol/L(结果保留三位小数).
15.在恒温恒压下,向密闭容器中充入4mol SO2和2mol O2,发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0.2min后生成SO3为1.4mol,同时放出热量Q kJ,则下列分析正确的是( )
| A. | 在该条件下,反应前后的压强之比为6:5.3 | |
| B. | 若反应开始时容器体积为2 L,则0~2 min内v(SO3)=0.35 mol/(L•min) | |
| C. | 在该条件下充入He气,各物质的反应速率都将增大 | |
| D. | 若反应改为“恒温恒容下”进行,放出Q kJ热量需要的时间将大于2 min |
16.属于短周期元素的是( )
| A. | K | B. | Ca | C. | I | D. | Cl |
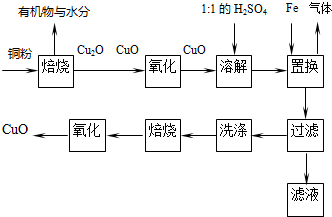
 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱之一.下面是它的一种实验室合成路线: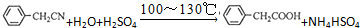

 某学生为测定未知浓度的硫酸溶液,进行如下实验:用1.00mL待测硫酸溶液配制100mL稀H2SO4溶液;以0.14mol•L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL.
某学生为测定未知浓度的硫酸溶液,进行如下实验:用1.00mL待测硫酸溶液配制100mL稀H2SO4溶液;以0.14mol•L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL.