题目内容
16.某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验.【实验1】铜与浓硫酸反应,实验装置如图所示.

实验步骤:
①先连接好装置,检验气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将Cu丝上提离开液面.
(1)装置 A 中发生反应的化学方程式为:2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,试管 C的作用是吸收多余的SO2,防止污染空气
(2)导管 D 的下端(虚线段)应位于液面下(填“液面上”或“液面下”),导管 D 的作用有:①实验结束后排除装置中的 SO2,②防倒吸.
【实验2】实验中发现试管内除了产生白色固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有 CuO、Cu2O、CuS、Cu2S.为探究甲的成分,进行了以下的实验.
查阅资料可知:Cu2O+2HCl═CuCl2+Cu+H2O,CuS、Cu2S 和稀 HCl不反应.
2Cu2O+O2$\frac{\underline{\;煅烧\;}}{\;}$4CuO,2CuS+3O2$\frac{\underline{\;煅烧\;}}{\;}$ 2CuO+2SO2
Cu2S+2O2$\frac{\underline{\;煅烧\;}}{\;}$2CuO+SO2
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如下的实验:

(3)固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有泥三角、坩埚(坩埚钳).
(4)煅烧过程中,除上述反应外,还可能发生反应
(5)下列对于固体甲的成分的判断中,正确的是(填字母选项)BCD.
A.固体甲中,CuS和Cu2S不能同时存在
B.固体甲中,CuO和Cu2O至少有一种
C.固体甲中若没有Cu2O,则一定有Cu2S
D.固体甲中若存在Cu2O,也可能有Cu2S.
分析 (1)装置A中发生反应的化学方程式为2H2SO4(浓)+Cu $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;C装置是吸收二氧化硫防止污染空气;
(2)防止生成气体从导管D处溢出,导管 D 的下端应位于液面一下,试管A中气体压强减小,空气从D导管进入试管A中;
(3)固体煅烧需要在坩埚内进行,据此选择需要的仪器;
(4)煅烧过程中可能铜会和氧气反应生成氧化铜;
(5)固体甲加入稀盐酸后,得到的蓝色溶液,说明固体甲的成分中CuO和Cu2O至少有一种.
分析反应:Cu+O2=CuO 增重;Cu2S+2O2=2CuO+2SO2 不变;2CuS+3O2=2CuO+2SO2 减重,
因题给“固体乙称取2.00g,氧气流中煅烧、冷却称量至恒重,得固体丙1.84g”,即实际减重了,说明必有CuS,还要有其他物质.讨论可能存在的情况可解答该题.
解答 解:(1)装置A中发生反应的化学方程式为2H2SO4(浓)+Cu $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,C中氢氧化钠吸收二氧化硫发生的反应,反应的离子方程式,SO2+2OH-=SO32-+H2O,防止污染空气,
故答案为:2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;吸收多余的 SO2,防止污染空气;
(2)为防止生成的气体溢出,导管 D 的下端(虚线段)应位于液面下,导管 D 的作用有:实验结束后排除装置中的 SO2,试管A中气体压强减小,空气从D导管进入试管A中,防止液体倒吸,
故答案为:液面下,防倒吸;
(3)固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有泥三角、坩埚(坩埚钳),
故答案为:泥三角、坩埚(坩埚钳);
(4)煅烧过程中,除上述反应外,还可能发生反应是铜单质和氧气反应生成氧化铜,反应的化学方程式为:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,
故答案为:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;
(5)经分析固体甲加入稀盐酸后,得到的蓝色溶液,说明固体甲的成分中CuO和Cu2O至少有一种,分析反应:Cu+O2=CuO 增重;Cu2S+2O2=2CuO+2SO2 不变;2CuS+3O2=2CuO+2SO2 减重;因题给“固体乙称取2.00g,氧气流中煅烧、冷却称量至恒重,得固体丙1.84g”,即实际减重了,说明必有CuS,还要有其他物质.讨论:①若有Cu2O,Cu2S可有可无;②若无Cu2O,必有Cu2S.故③中在煅烧过程中一定发生的反应的化学方程式为2CuS+3O2 $\frac{\underline{\;\;△\;\;}}{\;}$2CuO+2SO2,
经上分析,对于固体甲的成分的判断中,正确的是BCD,不正确的是A,
故答案为:BCD;
点评 本题整合和拓展了教材中的典型实验,侧重基本实验操作能力考查.一定要弄清楚课本中的基本实验,要通过动手做实验去了解仪器的结构、适用范围和工作原理,掌握常见气体的制备、除杂、收集、尾气处理等基本操作,熟悉教材中的典型实验装置,题目难度中等.

| A. | 氢氟酸显弱酸性,可用于雕刻玻璃 | |
| B. | NaClO溶液显碱性,可用于杀菌消毒 | |
| C. | NH4Cl分解时吸收大量的热,可用作阻燃剂 | |
| D. | CO2密度比空气大,可用作镁着火时的灭火剂 |
| A. | 推广使用燃煤脱硫技术,防治SO2污染 | |
| B. | 加大石油、煤炭的开采速度,增加化石燃料的供应量 | |
| C. | 研制开发燃料电池汽车,消除机动车尾气污染 | |
| D. | 实施绿化工程,防治扬尘污染 |
| A. | MgCl2是强电解质,电解氯化镁溶液可以制得镁 | |
| B. | 水泥冶金厂常用高压电除去工厂烟尘,利用了胶体的性质 | |
| C. | 晶体硅可用作制造太阳能电池和光导纤维 | |
| D. | 煤经过气化和液化等物理变化可以转化为清洁燃料 |
| A. | 用CCl4将溴从溴水中提取出来 | |
| B. | 向某无色溶液中加入硝酸银产生白色沉淀,证明溶液中含有Cl- | |
| C. | 采用加热的方法除去氯化钠固体中混有的氯化铵固体 | |
| D. | 用丁达尔效应鉴别淀粉胶体和食盐溶液 |
已知:
CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)△H1,
$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l);△H2
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(l);△H3
上述反应均为在溶液中的反应,则△H1、△H2、△H3的关系正确的是( )
| A. | △H1=△H2=△H3 | B. | △H2<△H1<△H3 | C. | △H2=△H3>△H1 | D. | △H2=△H3<△H1 |
| A. | 苯不与溴水反应,但苯能从溴水中提取溴单质 | |
| B. | 苯在一定条件下能发生加成反应和取代反应,但不能发生氧化反应 | |
| C. | 苯和乙烯都能使酸性KMnO4溶液褪色 | |
| D. | 苯在一定条件下与氢气、硝酸等发生加成反应 |
| A. | 3.9gNa2O2固体中含有的阴离子数为0.05 NA | |
| B. | 标准状况下,2.24LCCl4所含原子数为0.5 NA | |
| C. | 1L 0.1mol/L醋酸溶液中含有的CH3COOH分子数为0.1 NA | |
| D. | 56g铁丝与一定量Cl2发生反应,当铁粉反应完全时,电子转移的数目可能为2.2 NA |
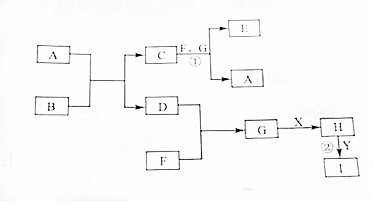 有关物质的转化关系如图所示(部分物质与条件已略去).其中A,D,F,G为常见的气体,D为单质,A,F,G为氧化物,G为棕红色;B为淡黄色固体.X是最常见的液体,Y是常见的金属单质,I溶液为蓝色,
有关物质的转化关系如图所示(部分物质与条件已略去).其中A,D,F,G为常见的气体,D为单质,A,F,G为氧化物,G为棕红色;B为淡黄色固体.X是最常见的液体,Y是常见的金属单质,I溶液为蓝色, .
.