题目内容
三聚氯氰是叫种重要的精细化工产品,广泛用于制造农药、染料、炸药、医药等工业.目前工业上生产三聚氯氰的反应原理为:3NaCN+3Cl2
3NaCl+ 下列有关说法正确的是( )
下列有关说法正确的是( )
| 活性炭 |
| 400℃ |
 下列有关说法正确的是( )
下列有关说法正确的是( )| A、三聚氯氰中C1的化合价是+1 |
| B、该反应中NaCN被还原 |
| C、三聚氯氰分子中既含σ键又含π健 |
| D、36.9 g三聚氯氰中含有1.204×1023个原子 |
考点:共价键的形成及共价键的主要类型,物质的量的相关计算,根据化学式判断化合价
专题:
分析:A.共价化合物中非金属性强的元素显负价;
B.反应中Cl元素的化合价降低,被还原;
C.单键中只含有σ键,双键中既含σ键又含π健;
D.根据n=
求出分子的物质的量,再求原子的物质的量和数目.
B.反应中Cl元素的化合价降低,被还原;
C.单键中只含有σ键,双键中既含σ键又含π健;
D.根据n=
| m |
| M |
解答:
解:A.共价化合物中非金属性强的元素显负价,组成三聚氯氰的三种元素中氯元素的非金属性最强,故Cl的化合价应为-1,故A错误;
B.3NaCN+3Cl2
3NaCl+ 反应中Cl元素的化合价降低,氯气为氧化剂,NaCN是还原剂,在反应中被氧化,故B错误;
反应中Cl元素的化合价降低,氯气为氧化剂,NaCN是还原剂,在反应中被氧化,故B错误;
C.三聚氯氰分子中含单键和双键,单键中只含有σ键,双键中既含σ键又含π健,故既含σ键又含π键,故C正确;
D.n=
=
=0.2mol,则分子数为1.204×1023,原子数目为1.0836×1024,故D错误.
故选C.
B.3NaCN+3Cl2
| 活性炭 |
| 400℃ |
 反应中Cl元素的化合价降低,氯气为氧化剂,NaCN是还原剂,在反应中被氧化,故B错误;
反应中Cl元素的化合价降低,氯气为氧化剂,NaCN是还原剂,在反应中被氧化,故B错误;C.三聚氯氰分子中含单键和双键,单键中只含有σ键,双键中既含σ键又含π健,故既含σ键又含π键,故C正确;
D.n=
| m |
| M |
| 36.9g |
| 184.5g/mol |
故选C.
点评:本题考查了化合价、共价键、物质的量的简单计算等,题目难度不大,注意单键中只含有σ键,双键中既含σ键又含π健.

练习册系列答案
相关题目
已知:常温下浓度为0.1 mol·L-1的下列溶液的pH如表:
溶质 | NaF | NaClO | Na2CO3 |
pH | 7.5 | 9.7 | 11.6 |
下列有关说法正确的是
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B.若将CO2 通入0.1 mol·L-1Na2CO3溶液中至溶液中性,则溶液中2 c (CO32ˉ)+ c (HCO3ˉ)= 0.1 mol·L-1
C.根据上表, 水解方程式ClOˉ+ H2O HClO + OHˉ的平衡常数K≈10ˉ7.6
HClO + OHˉ的平衡常数K≈10ˉ7.6
D.向上述NaClO 溶液中通HF气体至恰好完全反应时:c(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OHˉ)
常温下,下列各组离子在溶液中一定能大量共存的是( )
| A、Ca2+、K+、HCO3-、OH- |
| B、Al3+、NH4+、CO32-、Cl- |
| C、Na+、Ba2+、OH-、NO3- |
| D、H+、NH4+、SO32-、NO3- |
以下是在实验室模拟“侯氏制碱法”生产流程的示意图:则下列叙述错误的是( )


| A、A气体是NH3,B气体是CO2 |
| B、把纯碱及第Ⅲ步所得晶体与某些固体酸性物质(如酒石酸)混合可制泡腾片 |
| C、第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒 |
| D、第Ⅳ步操作是将晶体溶于水后加热、蒸发、结晶 |
 如图表示元素周期表前四周期的一部分,关于元素X,Y,Z,W的叙述正确的是( )
如图表示元素周期表前四周期的一部分,关于元素X,Y,Z,W的叙述正确的是( )①Y、Z的最高价氧化物对应的水化物的酸性为Y<Z
②W的阴离子在同周期阴离子中半径最小
③W、Z的氢化物的稳定性W<Z
④W的原子序数比Z的大9
⑤X的氢化物和它的最高价氧化物对应的水化物可以反应.
| A、只有② | B、①②⑤ |
| C、①②③ | D、①②④⑤ |
已知铍(Be)与铝的性质相似.则下列判断正确的是( )
| A、铍遇冷水剧烈反应 |
| B、氧化铍的化学式为Be2O3 |
| C、氢氧化铍能与氢氧化钠溶液反应 |
| D、氯化铍水溶液显中性 |
已知:Ksp(AgCl)=1.56×10-10,Ksp(AgI)=1.56×10-16,Ksp(Ag2CrO4)=2.0×10-12.下列有关说法正确的是( )
| A、相同温度下,饱和溶液中的Ag+浓度:AgCl>Ag2CrO4>AgI |
| B、向饱和食盐水中加AgNO3,形成AgCl沉淀时,溶液中的Ag+浓度为1.34×10-5 mol?L-1 |
| C、向含AgI难溶物的溶液中,逐滴加入饱和食盐水,原难溶物会变成白色 |
| D、向含Cl-、I-和CrO42-浓度均为0.010 mol?L-1的溶液中,逐滴加入AgNO3溶液,最先形成Ag2CrO4沉淀 |

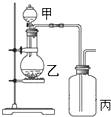 利用如图所示装置进行实验,能实现实验目的是(必要时可加热)( )
利用如图所示装置进行实验,能实现实验目的是(必要时可加热)( )