题目内容
已知:常温下浓度为0.1 mol·L-1的下列溶液的pH如表:
溶质 | NaF | NaClO | Na2CO3 |
pH | 7.5 | 9.7 | 11.6 |
下列有关说法正确的是
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B.若将CO2 通入0.1 mol·L-1Na2CO3溶液中至溶液中性,则溶液中2 c (CO32ˉ)+ c (HCO3ˉ)= 0.1 mol·L-1
C.根据上表, 水解方程式ClOˉ+ H2O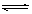 HClO + OHˉ的平衡常数K≈10ˉ7.6
HClO + OHˉ的平衡常数K≈10ˉ7.6
D.向上述NaClO 溶液中通HF气体至恰好完全反应时:c(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OHˉ)
C
【解析】
试题分析:A、根据表中数据及盐类水解规律:组成盐的酸根对应的酸越弱,该盐的水解程度越大,相同浓度时溶液的碱性越强,pH越大,注意Na2CO3所对应的酸为HCO3-,NaHCO3所对应的酸为H2CO3,酸性:HCO3-<HClO <H2CO3<HF,在相同温度下,同浓度的三种酸溶液的导电能力顺序:HClO<H2CO3<HF,错误;B、0.1 mol·L-1Na2CO3溶液中,c(Na+) = 0.2 mol·L-1,将CO2 通入0.1 mol·L-1Na2CO3溶液中至溶液中性,此时溶液为碳酸和NaHCO3 的混合液,溶液的体称没有变,溶液中的钠离子的浓度仍然为:c(Na+) =0.2 mol·L-1,根据电荷守恒有:c(Na+) + c(H+) = c (HCO3ˉ) + 2 c (CO32-) + c(OHˉ),由于溶液呈中性:c(H+) = c(OHˉ),则c(Na+) = 2 c (CO32ˉ)+ c (HCO3ˉ)= 0.2mol·L-1,错误;C、根据水解方程式:ClOˉ+ H2O HClO + OHˉ,水解的平衡常数表为;
HClO + OHˉ,水解的平衡常数表为; ,从上表可知常温下浓度为0.1 mol·L-1 NaClO溶液的pH=9.7,则c(OHˉ) = c(HClO)=10-4.3,所以K≈10ˉ7.6,正确;D、向NaClO 溶液中通HF气体至恰好完全反应时,此时溶液为等物质的量浓度的NaF和HClO的混合液,由于弱电解质的电离是微弱的,故溶液中c(HClO)>c(H+)、c(OHˉ),错误。
,从上表可知常温下浓度为0.1 mol·L-1 NaClO溶液的pH=9.7,则c(OHˉ) = c(HClO)=10-4.3,所以K≈10ˉ7.6,正确;D、向NaClO 溶液中通HF气体至恰好完全反应时,此时溶液为等物质的量浓度的NaF和HClO的混合液,由于弱电解质的电离是微弱的,故溶液中c(HClO)>c(H+)、c(OHˉ),错误。
考点:考查电解质溶液中粒子浓度大小比较。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| 活性炭 |
| 400℃ |
 下列有关说法正确的是( )
下列有关说法正确的是( )| A、三聚氯氰中C1的化合价是+1 |
| B、该反应中NaCN被还原 |
| C、三聚氯氰分子中既含σ键又含π健 |
| D、36.9 g三聚氯氰中含有1.204×1023个原子 |


 Z(g)+M(s),5min后达到平衡,此时生成a mol Z。下列说法正确的是
Z(g)+M(s),5min后达到平衡,此时生成a mol Z。下列说法正确的是